Sinnorientierte Medizin
Zusammenfassung
Die heutige Evidence-based Medicine hat dem praktizierenden Arzt eine große Fülle von statistischen Daten gebracht, aus denen die Verantwortlichen des Gesundheitssystems starke Argumente für und wider die Anwendung neuer Therapien herleiten. Bei eingehender Betrachtung rezenter Publikationen zeigt sich, dass die Argumente, durch eine neue Behandlung Leben zu retten, nicht immer durch die zugrunde gelegten Daten gestützt sind. Diese zeigen, dass in Wahrheit die Behandlung nur zu einer relativ kurzen Lebensverlängerung führt. Als Ergebnis unserer Recherchen schlagen wir daher ein mathematisches Modell vor, das den Gewinn einer Therapie für den individuellen Patienten in Form einer erwarteten Lebenszeitverlängerung einbezieht. Wenn man die Dauer einer Behandlung und die individuellen Gewinne an erwarteter Lebenszeit einbezieht, kann ein Effektivitätsquotient ermittelt werden, der dazu benützt werden kann, die medizinischen Therapien nach ihrer Effektivität einzustufen. Unser Modell ist die Basis für eine neue Medizin, der es um den individuellen Patienten geht, unter Heranziehung einer Medizin, die sich an Therapien orientiert, die Sinn machen (Sinnorientierte Medizin – S.O.M.).
Schlüsselwörter: Evidence-based Medicine, Lebensverlängerung, absolute und relative Risikoreduktion
Abstract
Todays evidence based medicine has brought the practicing physician a vast amount of statistical evidence from which stakeholders of the health care system derive strong arguments for and against the use of new therapies. By looking at published data we discovered, however, that arguments for a lifesaving by a new treatment are not always supported by the underlying data, but show that in real terms the effect of the treatment is reduced to a relativly short gain in lifetime. As a result we therefore propose a mathematical model which takes into account the benefit of a treatment for the individual patient in terms of expected lifetime gain. Considering the duration of treatment and the individual gain in expected lifetime there can be derived a coefficient of effectiveness which can be used to categorize medical treatments. Our model is the basis for a new perspective towards a medicine that works around the individual patient with the use of a medicine that is oriented towards therapies that make sense (Sense Oriented Medicine – S.O.M.).
Keywords: Evidence-based Medicine, Lifetime-Gain, Absolute and Relative Risk Reduction
Heute wird weltweit eine sog. Evidence Based Medicine (EBM) eingefordert.1 Dazu werden immer mehr groß angelegte kontrollierte randomisierte Multicenterstudien durchgeführt und mithilfe von bestimmten statistischen Techniken zu Metaanalysen zusammengefasst.
Wenngleich die EBM sicherlich sehr positive Seiten hat – z. B. zur Eindämmung der Scharlatanerie jeglicher Provenienz –, so besteht die Kehrseite dieser Entwicklung nun darin, dass Ärzte, aber auch Zulassungsbehörden und Krankenkassen, heute mit einer Unmenge von Daten konfrontiert werden, aufgrund derer eine ganz bestimmte Therapie zum Teil mit einer Unbedingtheit gefordert wird, die den Arzt in ein fast unlösbares Entscheidungsdilemma stürzen kann.
Da stehen auf der einen Seite die Pharmaindustrie, dann die Leitlinienmedizin von sog. Expertengremien und Konsenskonferenzen. Auf der anderen Seite stehen die ökonomischen Zwänge, angeführt von den Krankenkassen, Gesundheitspolitikern und Arzneimittelkommissionen. Weiter erschwert wird die Entscheidung des Arztes durch eine oft unsachgemäß übertriebene Interpretation und Präsentation der Studienergebnisse, unterstützt durch raffinierte Marketing-Strategien und geschickte Medien-Propaganda. Nicht zu vergessen, und damit im Zusammenhang stehend, ist die Patientenbegehrlichkeit.
So stellt sich immer dringlicher die Frage: Wie relevant sind die signifikanten Daten und die damit verbundenen Forderungen wirklich? Das Konzept einer sinnorientierten Medizin beschäftigt sich eingehend mit dieser Problematik und bietet Ansätze zu einer Lösung.2 Deren Motto lautet:
Rationalisierung statt Rationierung
Effizienz statt Verschwendung
Sinnvolle Ressourcenverteilung
Absolutes und relatives Risiko
Zunächst einmal ist es heute üblich, statt der absoluten meistens nur die sog. relative Risikoreduktion anzugeben, was von vornherein zu einer kapitalen Fehleinschätzung der Relevanz bestimmter Behandlungen führt.
Zur Veranschaulichung sei eine Studie zur Cholesterinsenkung mit Statinen herausgegriffen (Abbildung I).3
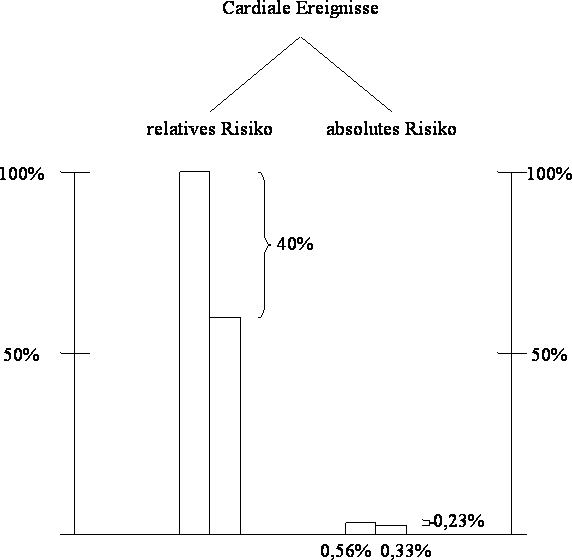
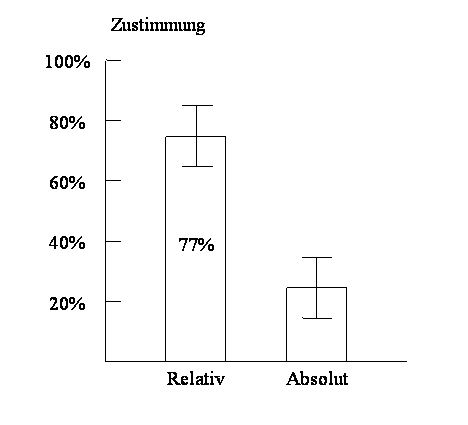
Herzinfarkte können um 40% gesenkt werden, heißt es – wie üblich – in der Propaganda, also fast um die Hälfte. Das klingt ziemlich gut. Analysiert man die Daten genauer, so zeigt sich, dass das absolute Risiko, einen Herzinfarkt zu bekommen, bei den unbehandelten Patienten 0,56% pro Jahr betrug. Durch die Behandlung konnte diese Ereignisrate auf 0,33% gesenkt werden. Dies bedeutet eine absolute Reduktion um nur 0,23% pro Jahr, also zwei Promille. Von der propagierten 40%igen Risikoreduktion bleibt also fast nichts über. Hier zeigt sich, dass die Senkung eines relativen Risikos über die therapeutische Relevanz einer Behandlung wenig aussagt. Dies ist vor allem deshalb wichtig, weil die Bereitschaft des Arztes, aber auch der Zulassungsbehörde oder der Krankenkasse, ein neues Medikament in die Therapie einzuführen, stark davon beeinflusst wird, wie man ihnen die Daten präsentiert. Es konnte z. B. in einer Studie zur Cholesterinsenkung gezeigt werden, dass Ärzte viel eher geneigt sind, ein Medikament zu verschreiben (nämlich zu 77%), wenn ihnen nur die relativen Risikozahlen einer Studie präsentiert wurde, jedoch nur mehr zu 24%, wenn die Ergebnisse derselben Studie in absoluten Zahlen angegeben wurden.4 Trotzdem, oder vielleicht gerade deshalb, werden Studienergebnisse fast nur mehr in Relativzahlen präsentiert (Abbildung II).
Koronarereignisse verhindern?
Weiters sollte mit der Fiktion aufgeräumt werden, dass durch die medikamentöse Therapie Ereignisse oder gar der Tod verhindert werden können. Nicht nur in der Werbung, sondern in praktisch allen Publikationen ist die Rede davon, dass Myocardinfarkte, Schlaganfälle, Schenkelhalsfrakturen, ja selbst der Tod durch Medikamente „verhindert" werden können.
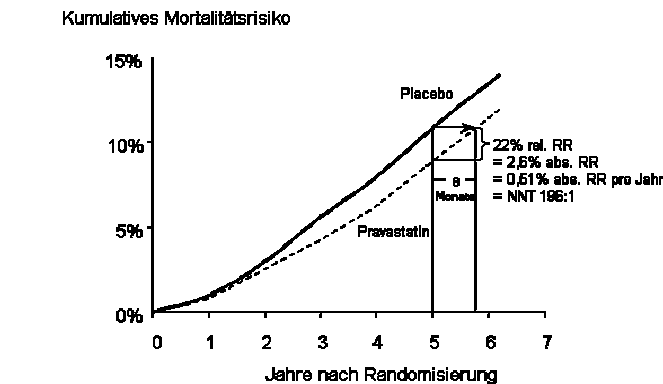
Zur Illustration betrachte man die kumulativen Mortalitätskurven aus der LIPID-Studie5 (Abbildung III), einer Studie zur Cholesterinsenkung mit den heute so enthusiastisch propagierten Statinen.
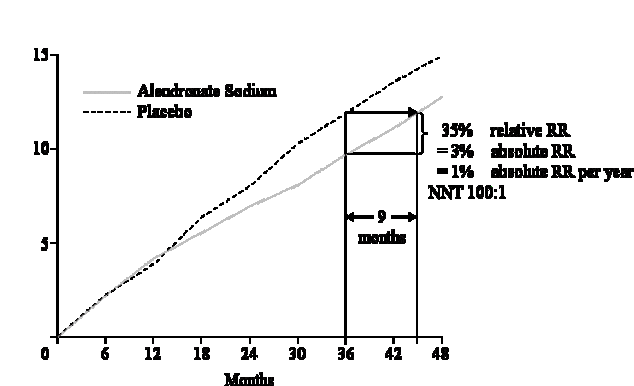
Nach 5 Jahren betrug die Mortalitätsrate in der Placebogruppe 10%, in der Pravastatingruppe hingegen nur 7,4%. Das ist eine relative Risikoreduktion von 22% bzw. absolut von 2,6% in 5 Jahren. Das heißt aber nicht, dass die Patienten der gewonnenen 2,6% nicht sterben – dann müsste die untere Kurve in Abbildung III in ein Plateau auslaufen – sondern bereits 8 Monate später waren in der Behandlungsgruppe genauso viele Patienten tot wie in der Kontrollgruppe. Es kann also durch eine Therapie mit Statinen (Pravastatin) innerhalb von 5 Jahren nur eine relativ geringe Verschiebung des Todeszeitpunktes oder der Koronarereignisse um einige Monate erreicht werden. Dieser Effekt ist wohl ganz anders zu werten, als wenn von „geretteten Menschenleben" bzw. von Herzinfarktverhinderung gesprochen wird.6 Hier wäre es redlicher, nur von Lebensverlängerung statt von Lebensrettung (bzw. Infarktverhinderung) zu sprechen.
Man kann mit Hilfe eines mathematischen Computermodells die durchschnittliche Lebensverlängerung oder Ereignisverzögerung durch Medikamente sehr gut berechnen.7 Sie hängt ganz wesentlich von der Lebenserwartung, also vom Alter des Patienten ab, was leicht z. B. anhand der LIPID-Studie zu demonstrieren ist (die folgenden Berechnungen wurden von K. Felsenstein am Institut für Statistik auf der Technischen Universität Wien durchgeführt).8
In Abbildung IVA sieht man ganz rechts die Überlebenskurve für die Durchschnittsbevölkerung verglichen mit den Überlebenskurven von Risikopatienten unter Placebo- und unter Statin-Behandlung für Patienten im Alter von 45 Jahren. Daraus ist ersichtlich, dass durch die lebenslange Einnahme von Statinen zwar eine leichte Rechtsverschiebung der Überlebenswahrscheinlichkeit bewirkt wird, keinesfalls kann die Kurve jedoch in den Bereich der Durchschnittsbevölkerung verschoben werden, was einer echten Lebensrettung entsprechen würde. Im Mittel kann die verbleibende Lebenserwartung bei einem 45jährigen Patienten von 23 auf 25,3 – also um maximal 2,3 Jahre verlängert werden, wenn er in dieser Zeit das Medikament ständig einnimmt. Da fehlen also noch einige Jahre bis zu einer echten Normalisierung (nämlich 10 Jahre).
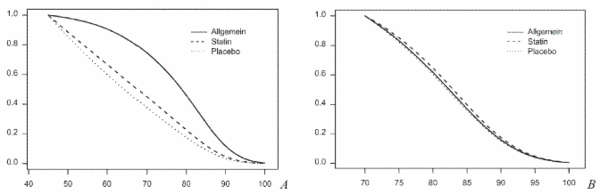
Berechnet man den Effekt der Therapie für 70jährige Patienten, so bleibt sozusagen nur mehr sehr wenig Zeit für eine effektive Behandlung, da der an sich vorhandene Effekt durch die natürliche Sterberate abgefangen wird (Abbildung IVB). Das koronare Ereignis oder der Tod können im Durchschnitt maximal um ein halbes Jahr hinausgeschoben werden. Hier tritt zu Tage, dass ein und dieselbe Therapie in jüngeren Jahren wesentlich effektiver ist als im Alter, d. h. für diese alten Patienten kaum mehr relevant ist.
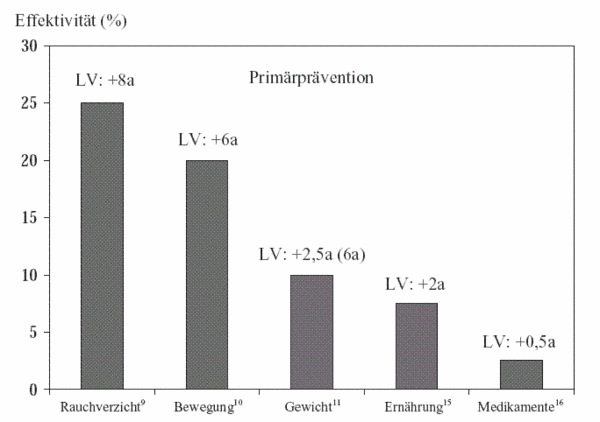
Effektivitätsquotient (Wirkungsgrad)
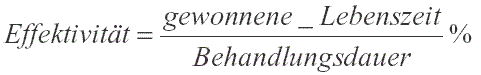
Um die Relevanz einer Therapie abzuschätzen, kann auch der Effektivitätsquotient (E-Quotient) berechnet werden. Die Effektivität berücksichtigt nicht nur das Ausmaß des Gewinns, sondern auch den Zeitfaktor, in dem dieser Gewinn erreicht wird. Sie errechnet sich aus dem Quotient der gewonnenen Lebenszeit und der Behandlungsdauer und wird in Prozent angegeben. Eine Insulintherapie bei Typ-I-Diabetes ist z. B. höchst effektiv, weil die gewonnene Lebenszeit der Behandlungsdauer entspricht (Effektivität 100%). Aus der Abbildung V (und Tabelle I) ist ersichtlich, dass Präventivmaßnahmen zur Lebensstiländerung um ein Vielfaches effektiver sind als z. B. eine Primärprävention mit Medikamenten, was kaum je erwähnt wird. Durch Rauchverzicht können in 30 Jahren ca. 8 Jahre gewonnen werden (Effektivität 25%). Regelmäßige körperliche Bewegung bringt mindestens 6 Jahre, Gewichtsreduktion 2 bis 6 Jahre (je nach Ausgangswert). Eine gesunde Ernährung 2 Jahre. Alles zusammengerechnet ergibt eine Verlängerung der Lebenserwartung um 20 Jahre bei gesunder Lebensführung, während eine präventive Medikamenteneinnahme im Bereich von 0,5 – 1 Jahr liegt. Dabei ist zu bedenken, dass z. B. die Einnahme eines Statins über 20 Jahre Kosten von EUR 22.000,– pro Patient verursacht. Jedenfalls dürfte eine Effektivität unter 5% nicht mehr relevant und damit auch nicht mehr sinnvoll sein.
| Risikofaktor | Behandlungsdauer | Lebensverlängerung | Effektivität |
|---|---|---|---|
| Antibiotikumtherapie/Pneumonie | 2 Wochen | Heilung | >> 100% |
| Insulintherapie bei Typ-I-Diabetes | lebenslänglich | 1:1 | 100% |
| Verzicht auf Rauchen (Männer) ab 40a9 | 36,3a (LE) | 9,1a | 25% |
| Wandern (65a)10 | 14,5a (LE) | +5a | 34% |
|
Gewichtsreduktion11 +45% Übergewicht ab 50a |
29a (LE) | 6,7a | 23% |
| Osteoporose | 18a | 2,2a | 12% |
|
Gewichtsreduktion11 +20% Übergewicht |
29a (LE) | 2,3a | 7,9% |
| Statintherapie bei Hochrisikopatienten in der Sekundärprävention12 im Alter von 45a | 29,5a (LE) | 2,3a | 7,7% |
| PKW13 | 30a (LE) | +1,0a | 3,3% |
| Primärprävention mit ASS (50a) bei gesunden Männern14 | 26a (LE) |
0,5a (6 Monate) |
1,9% |
| Primärprävention bei Cholesterin 240 mg% auf Zielwert 200 mg im Alter von 45a16 | 30a (LE) |
0,4a (4,9 Monate) |
1,3% |
Korrekturfaktoren der Effektivität
Toxizitätsindex (TI), Lebensqualitätsindex (LQI), QUALY, Risken
In diesem Zusammenhang muss aber ergänzt werden, dass eine Behandlung (in welcher Indikation immer) nicht nur die positiven Effekte, wie z. B. Lebensverlängerung und Ereignisverzögerung, im Auge behalten darf, sondern auch die Lebensqualität und die mit der Behandlung verbundenen unerwünschten Nebenwirkungen und Risiken (auf das aktuelle Drama mit dem Präparat Vioxx sei verwiesen). Auf eine nur geringe Lebensverlängerung (bzw. Ereignisverzögerung) wird man möglicherweise verzichten, wenn als Preis erhebliche Nebenwirkungen und ein Verlust an Lebensqualität in Kauf genommen werden müssen. Dazu können die gewonnenen Jahre in sog. qualitätsangepasste Lebensjahre (QUALY) umgerechnet werden, wo gleichsam eine Schaden-/Nutzen-Relation hergestellt wird.17 Dabei werden die mit der Behandlung verbundenen Nebenwirkungen und Risiken in die Kalkulation miteinbezogen, indem die Behandlungsjahre mit einem Toxizitätsfaktor (TF) und ggf. einem Lebensqualitätsindex korrigiert werden.
QUALY = Überlebenszeit x LQI x TF (= 1 – TI)
Der ökonomische Faktor: Die Kosteneffizienz
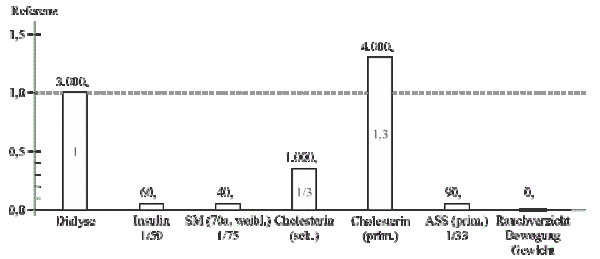
Die Ressourcenknappheit zwingt die immer aufwändigere Medizin zu einer gerechten Verteilung der nicht unbegrenzten Mittel. Die mathematische Berechnung der Lebensverlängerung nach der S.O.M.-Methode ermöglicht auch die Berechnung des finanziellen Aufwands einer Therapie, indem die Kosten für ein Jahr (bzw. 1 Monat) Lebensverlängerung ermittelt werden.7 Dabei kann sowohl ein Kostenvergleich zwischen mehreren Therapieansätzen erstellt werden (interner Kostenvergleich), als auch eine Abschätzung der absoluten Kosten und deren Verhältnismäßigkeit erfolgen (externer Kostenvergleich). Als anerkannter Standard für einen externen Kostenvergleich gelten als Toleranzgrenze die Monats- bzw. Jahreskosten für eine Dialysebehandlung (EUR 3.000 pro Monat = EUR 36.000 pro Jahr).
Dabei ist zu bedenken, dass der Gewinn bei der Dialysebehandlung 1:1 umgesetzt wird. D. h. 1 Monat Behandlung bringt auch 1 Monat Lebensverlängerung d. h. die Effektivität ist 100%.
In Abbildung VI ist ein Kostenvergleich verschiedener therapeutischer Maßnahmen dargestellt.
Links sind die Kosten für einen gewonnenen Monat unter Dialyse mit EUR 3.000,– als Referenz mit 1 eingetragen. Ein gewonnener Monat unter Insulinbehandlung bei Typ-I-Diabetes kostet 1/50 davon, nämlich EUR 60,–, eine Schrittmachertherapie EUR 40,–. Eine Statintherapie zur Cholesterinsenkung in der Sekundärprophylaxe (also nach einem Herzinfarkt) immerhin EUR 1.000,– pro gewonnenem Lebensmonat, das ist 1/3 von einer Dialysebehandlung. Nimmt man aber Statine bereits zur Primärprophylaxe bei hohem Cholesterinwert, was heute der Trend ist, so steigen die Kosten schon weit über die Toleranzgrenze von EUR 3.000,–/Monat. Die Effektivität einer Primärprophylaxe mit Aspirin ist zwar auch nicht besser als die Cholesterinsenkung mit Statinen, der gewonnene Monat kostet allerdings nur EUR 90,–, also nur 1/33 einer Dialyse bzw. 1/44 einer Statintherapie. Ein vernünftiger Lebensstil, z. B. Rauchverzicht, kostet freilich nichts, ja es kann sogar Geld eingespart werden und ist, wie wir vorhin gesehen haben, wesentlich effektiver.
S.O.M.-Stufenplan (Therapieabwägung über EBM hinaus)
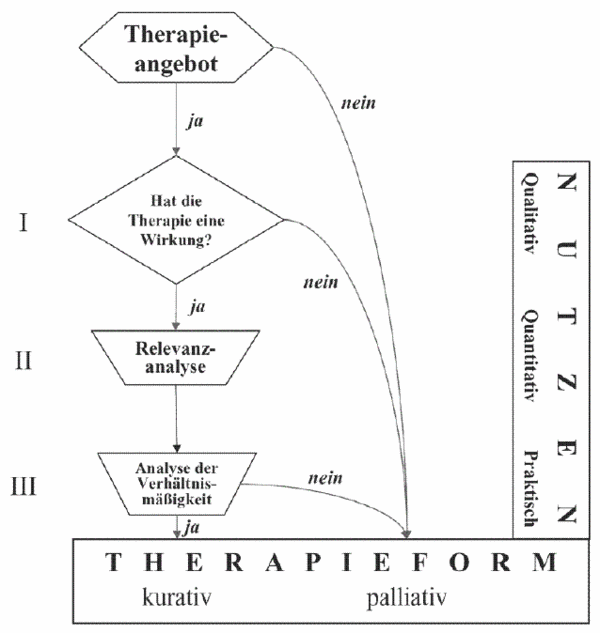
Aus den bisherigen Ausführungen ergibt sich ein schrittweiser Stufenplan zur Entscheidungsfindung für eine sinnvolle Therapie, der über die reine EBM (Evidence-based Medicine) hinausgeht.
Man kann diesen Stufenplan auch in einem Algorithmus darstellen (siehe Abbildung VII): In Stufe 1 muss zunächst untersucht werden, ob eine angebotene Therapie nach den Kriterien der Evidence Based Medicine wirksam ist. Wenn nein, so kann auf allgemeine Maßnahmen zur Verbesserung der Lebensqualität bzw. auf eine palliative Therapie abgestellt werden. Wenn ja, dann muss die Wirkung quantifiziert und in Stufe 2 durch Berücksichtigung von Toxizität und Risiken die Relevanz beurteilt werden, um dann in Stufe 3 eine Verhältnismäßigkeitsanalyse insbesondere bzgl. der Kosten durchführen zu können. Dabei wird letztlich entschieden, ob eine kurative bzw. lebensverlängernde oder eine palliative Therapie zur Verbesserung der Lebensqualität für den je konkreten Patienten praktisch sinnvoll, d. h. hilfreich erscheint.
Dieser Stufenplan ist auch deshalb so wichtig, weil er hilft, die trügerischen Klippen einer überzogenen kurativen Medizin, wo Lebensverlängerung nur mehr Leidensverlängerung bewirkt, rechtzeitig zu erkennen, um sich dann schwerpunktmäßig der Palliativmedizin bzw. der Verbesserung der LQ zuzuwenden.
Im Folgenden einige Beispiele zur Kosten-/Nutzen-Analyse:
1. Beispiel: Temodal®-Studie (Temozolomide)
Als Beispiel sei die adjuvante Behandlung von Patienten mit Glioblastom mit Temodal® herangezogen. Diese Studie wird ausführlich von W. Rella in dieser Ausgabe beschrieben.18
Die Fragestellung war: Kann der adjuvante Einsatz von Temodal® zusätzlich zur Chirurgie und Radiotherapie bei hochmalignem Glioblastom hinsichtlich Lebensverlängerung und Verbesserung der Lebensqualität im Vergleich zur herkömmlichen Chemotherapie seinen Preis rechtfertigen? Dabei wird heute als Hauptargument für die Temodal®-Therapie das vergleichsweise günstige Nebenwirkungsprofil angeführt; Übelkeit und Erbrechen sind milder als bei anderen Carbacinen, Haarausfall kommt nicht vor.
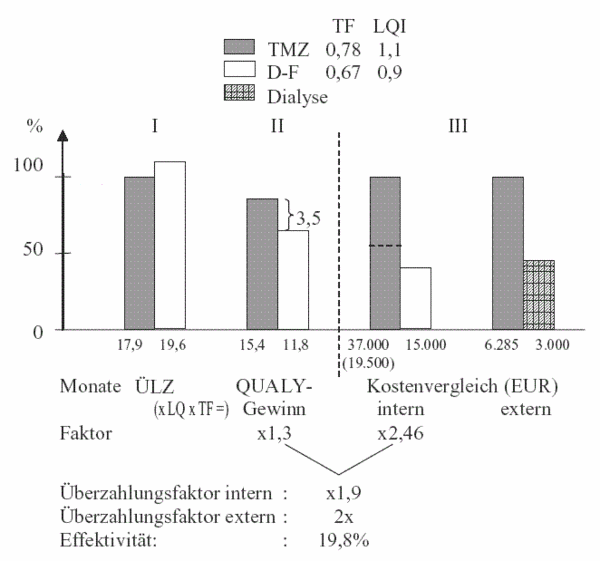
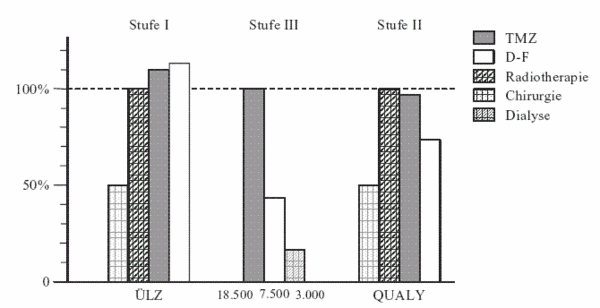
Verglichen wurde eine Studie von Stupp und Mitarbeitern (2002) unter TMZ mit einer Studie von Fazeny-Dörner (2003)19 (Kombinationstherapie von D + F = Natulan® + Musphoran®) mit folgenden Resultaten (Abb. VIII):
Die ersten Säulen zeigen die Überlebenszeiten unkorrigiert in den beiden Gruppen (Stufe I). Es besteht praktisch kein Unterschied. Die Überlebenszeit in der D-F-Gruppe war sogar etwas länger als in der Temodal®-Gruppe. Vergleicht man allerdings den Toxizitätsfaktor und die Lebensqualitätindexe (Stufe II), so finden sich unter Temodal® deutlich günstigere Werte. Dies manifestiert sich auch in den Ergebnissen der QUALY-Berechnungen. Nach der Korrektur ergeben sich 15,4 Qualitätsadjustierte Jahre (QUALYs) unter Temodal® und nur 11,8 unter D-F, das gibt einen Vorteil für Temodal® um 3.5 QUALY-Monate bzw. einem Gewinnfaktor von 1,3. Vergleicht man nun aber in Stufe III die Kosten, so stehen sich EUR 37.000 und EUR 15.000 gegenüber, das ist ein Faktor von 2,6. Der Gewinnfaktor von 1,3 (3,5 QUALY-Monate) würde Mehrkosten von EUR 4.500,– rechtfertigen (also insgesamt EUR 19.500,–), nicht aber EUR 37.000,–.
Auch im externen Kostenvergleich schneidet Temodal® insofern schlecht ab, als sich die Kosten für einen zusätzlich gewonnenen QUALY-Monat auf EUR 6.000,– belaufen und damit doppelt so teuer ist wie eine Dialysebehandlung.
Wie problematisch aber die Chemotherapie an sich bei Glioblastom ist, zeigt die nächste Abbildung IX, bei der die Effektivität der Chemotherapie verglichen zu einer alleinigen Radiotherapie (also Verzicht auf Chemotherapie) untersucht wurde.
Auf der linken Seite sind die Überlebenszeiten nach den Kriterien der EBM unkorrigiert aufgetragen (Stufe I). Die durchschnittliche Lebenserwartung bei einem Patienten mit Glioblastom nach dem chirurgischen Eingriff beträgt etwa 8 Monate. Durch die Radiotherapie kann diese Lebenserwartung verdoppelt werden und durch die Chemotherapie gewinnt man noch ca. 10%, also in unserem Fall noch ca. 2 Monate dazu. Stellt man die Kosten für einen zusätzlichen Überlebensmonat der beiden Therapiealternativen ins Verhältnis zu den Kosten einer Dialysebehandlung, ohne zunächst den Toxizitätsfaktor zu berücksichtigen,20 so ergibt sich, dass ein gewonnener Monat unter Temodal® EUR 18.500,– kostet und damit 6x so teuer ist wie eine Dialysetherapie. Aber auch das D-F-Schema ist noch um das 2,5fache zu teuer.
Berechnet man aber in Stufe II nach der S.O.M. die Toxizität mit ein, so ist der QUALY-Verlust so groß, dass der Effekt geringer ist, als wenn man auf die Chemotherapie verzichten und die Radiotherapie alleine durchführen würde. D. h. eine Chemotherapie bei Glioblastom erscheint schon auf Basis der Schaden-/Nutzen-Analyse als wenig sinnvoll, weil die Lebensverlängerung nur Leidensverlängerung, aber nicht Leidenslinderung bewirkt.
Zusammenfassend ergibt also die S.O.M.-Analyse:
Stufe I: Nach den Kriterien der EBM kann beim Glioblastom durch eine adjuvante Chemotherapie eine signifikante Lebensverlängerung erreicht werden.
Stufe II: Im Vergleich zu einer herkömmlichen Chemotherapie (D-F-Schema) kann mit Temodal® zwar keine zusätzliche Lebensverlängerung, aber eine vergleichsweise bessere Lebensqualität und damit ein Gewinn an Qualitätsadjustierten Jahren (QUALYs) erreicht werden.
Stufe III: Dieser Vorteil hält jedoch einer Verhältnismäßigkeitsprüfung zu den damit verbundenen Kosten nicht stand. Die Behandlung ist um das 2fache teurer als sie sein dürfte, gemessen an der herkömmlichen Chemotherapie und auch gemessen an einer Dialysebehandlung.
Letztlich stellt sich abgesehen von den überhöhten Kosten anhand der Qualy-Analyse die Frage, ob man in diesem Fall dem Patienten durch die toxischen Effekte der Chemotherapie nicht mehr schadet als nützt und es nicht besser wäre, auf die Chemotherapie ganz zu verzichten und sich primär der Palliativmedizin zuzuwenden (siehe oben), zumindest dann, wenn die Chemotherapie nicht gut vertragen wird. Das gilt sowohl für Temodal®, und erst recht für das D-F-Schema. Eine vernünftige Vorgangsweise nach den Prinzipien der S.O.M. wäre z. B. ein individuelles Vorgehen:
- Versuch einer herkömmlichen Chemotherapie als first-line-Option.
- Bei Unverträglichkeit Temodal® als second-line-Option.
- Wenn auch Temodal® schlecht vertragen wird, Verzicht auf eine krankheitsspezifische Therapie und Übergang zur reinen Palliation.
2. Beispiel: Osteoporosetherapie
Ein weiteres Beispiel ist der Beginn einer Osteoporosetherapie auf der Basis von Knochendichtemessungen. Heute wird als Normalwert die Knochendichte einer 30 Jahre alten gesunden Frau zugrunde gelegt, ohne dass der normale Knochenabbau im Alter berücksichtigt wird. Die Folge ist, dass sich bei fast allen Frauen ab dem 50. Lebensjahr eine erniedrigte Knochendichte finden lässt, sodass auch prompt mit einer Behandlung begonnen wird, mit dem Argument, dadurch könnten Knochenbrüche verhindert werden. Aber auch hier gilt, dass Brüche ja nicht verhindert, sondern nur hinausgeschoben werden können. Zur Illustration betrachte man die kumulative Frakturrate an Knochenbrüchen aus der Studie von Cummings und Mitarbeitern mit Alendronat.21 Nach 3 Jahren betrug die Frakturrate in der Placebogruppe ca. 12%, in der Behandlungsgruppe mit Bisphosphonat hingegen nur 9%, d. h. aber nicht, dass die Differenz von 3% (relative Risikoreduktion -30%) keine Frakturen bekommen. Denn dann müsste die untere Kurve in Abbildung X in ein Plateau auslaufen. Vielmehr hatten bereits 8 Monate später in der Bisphosphonatgruppe genauso viele Patienten eine Fraktur wie in der Kontrollgruppe. Es kann also durch die Osteoporosetherapie innerhalb von 3 Jahren bei 10% aller Frauen nur eine relativ geringe Verschiebung des Frakturzeitpunktes um einige wenige Monate (im Mittel 4,5 Monate) erreicht werden. Dieser Effekt ist wohl ganz anders zu werten, als wenn von Frakturverhinderung gesprochen wird.
Dazu kommt noch die Tatsache, dass bei einer 50jährigen Frau die Wahrscheinlichkeit, einen Knochenbruch zu erleiden, minimal ist. Die Untersuchungen von Cummings wurde nämlich bei im Durchschnitt 68 Jahre alten Frauen durchgeführt.
| Risikoreduktion 40% | |||||||
| Alter | EE | EE treat | Diff (a) | LZ (%) | LZ treat (%) | Diff LZ (%) | Effekt (%) |
| 50 | 24,4 | 26,8 | 2,4 | 63,96 | 49,55 | 14,41 | 8,96 |
| 60 | 16,2 | 18,4 | 2,2 | 64,54 | 49,87 | 14,67 | 11,96 |
| 65 | 12,5 | 14,5 | 2,0 | 64,79 | 49,90 | 14,89 | 13,79 |
| 70 | 9,5 | 11,2 | 1,7 | 64,01 | 48,94 | 15,07 | 15,18 |
| 75 | 7,1 | 8,5 | 1,4 | 61,77 | 46,62 | 15,15 | 16,47 |
| 80 | 5,3 | 6,3 | 1,0 | 57,69 | 42,71 | 14,98 | 15,87 |
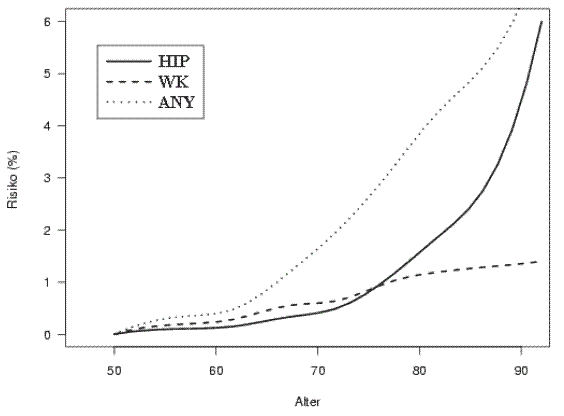
Aus Abbildung XI geht hervor, dass die Frakturrate bis zum 65. Lebensjahr im Promille-Bereich liegt, erst ab dem 65. Lebensjahr steigt die Kurve stark an, bei den Hüftgelenksfrakturen erst ab dem 75. Lebensjahr, dann allerdings exponentiell.
Mit Hilfe unseres Computermodells konnten wir jedenfalls errechnen, dass eine 50jährige Frau mit erniedrigter Knochendichte frühestens in 24,4 Jahren, also mit 74 Jahren, mit einer Knochenfraktur rechnen muss. Durch eine Therapie z. B. mit Bisphosphonaten, wie es heute üblich ist, kann dieses Ereignis bestenfalls um 2,4 Jahre hinausgeschoben werden. Das Lebenszeitrisiko, eine Fraktur zu erleiden, wird um 14% reduziert. Das eigentlich Benerkenswerte an den Ergebnissen ist aber, dass kein Unterschied besteht in Bezug auf die Reduktion des Lebenszeitrisikos, ob eine Therapie mit 50 Jahren oder mit 65 Jahren begonnen wird. Auch bezüglich der Frakturverschiebung ist der Unterschied nur sehr gering (2,4 vs. 2,0 Jahre), was sich durch die Berücksichtigung des Toxizitätsindex (0,97) spielend ausgleicht.
Mit anderen Worten: Bei erniedrigter Knochendichte (präklinische Osteoporose) ist der Effekt einer Behandlung, die ab dem 65. Lebensjahr begonnen wird, gleich gut wie ab dem 50. Lebensjahr. (Einsparung von 15 Behandlungsjahren mit Bisphosphonaten z. B. = EUR 7.800,–)
Das sind hochgerechnet auf die große Anzahl von Frauen, die wegen Osteoporose behandelt werden, Einsparungen in Milliardenhöhe, ohne dass dadurch die Patientinnen einen Nachteil hätten, im Gegenteil: Alle Medikamente haben auch Nebenwirkungen, die gerade auch in der Osteoporosetherapie nicht unerheblich sind. Wenn man diese einer Frau über 15 Jahre hindurch ersparen kann, ist dies alleine schon ein erheblicher Gewinn.
3. Beispiel: Hormonersatztherapie (Langzeitbehandlung)
Bekanntlich tobt derzeit eine heftige Kontroverse um die Hormonersatztherapie (HRT), die in den letzten Jahren nicht nur zur Besserung von Wechselbeschwerden, sondern zunehmend wegen ihrer Wirkung bei der koronaren Herzkrankheit, Osteoporose oder Morbus Alzheimer empfohlen wurde. Trotz einiger negativer Studien aus letzter Zeit wird die HRT von namhaften Gynäkologen weiter empfohlen und deren negative Effekte bagatellisiert.
Wir haben mit Hilfe unserer Berechnungsmethode diesen Schaden sozusagen quantifiziert. Dabei wurden Schaden und Nutzen anhand des Lebenszeitrisikos und auch durch Berechnung von Verlust und Gewinn krankheitsfreier Jahre gegeneinander aufgerechnet. Daraus ergibt sich bei Langzeitbehandlung (Abbildung XII): Durch die günstige Wirkung auf die Osteoporose kann 1 Jahr gewonnen werden. Durch Hintanhaltung von Darmkrebs 0,3 Jahre. Dagegen steht allerdings ein Verlust durch erhöhte Morbidität an Herzkrankheiten, Venenthrombosen, Schlaganfällen, Brustkrebs und Gallenblasenleiden, die den Gewinn weit übersteigt. Es kommt in Summe zu einem Verlust von 4,8 krankheitsfreien Jahren.
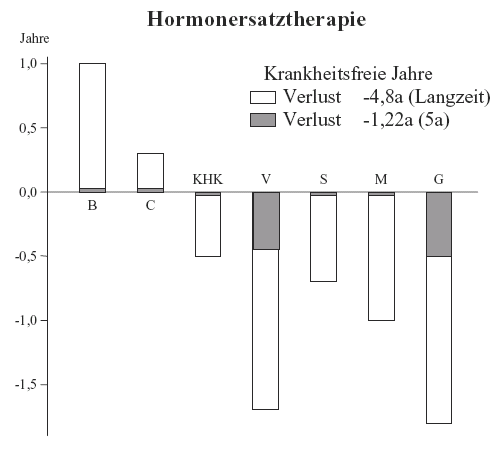
| 50a | Lebenszeitrisiko | Krankheitsfreie Jahre | ||||
| Kontrolle % | treat % | Diff % | Kontrolle a | treat a | Diff a | |
| Koronare Herzkrankheit | 18,26 | 22,49 | +4,23 | 30,88 | 30,36 | -0,51 |
| Venenthrombosen | 7,84 | 17,16 | +9,32 | 31,53 | 29,87 | -1,72 |
| Schlaganfall | 15,92 | 21,22 | +5,30 | 30,96 | 30,26 | -0,70 |
| Mammakarzinom | 9,84 | 17,89 | +8,05 | 31,35 | 30,37 | -0,98 |
| Gallensteine | 31,19 | 39,92 | +8,73 | 27,14 | 25,33 | -1,81 |
| Brüche (ANY) | 38,39 | 29,73 | -8,66 | 28,40 | 29,40 | +1,00 |
| Kolonkarzinom | 5,97 | 4,16 | -1,80 | 31,83 | 32,14 | +0,30 |
| Summe | +23,90 | -4,24 | ||||
| Summe korr. TF = 0,965 (Verlust an gesunden Lebensjahren) | -5,53 | |||||
Netto-Bilanz (Dauerbehandlung ab 50a, vgl. Tabelle III):
- Lebenszeitrisiko: Schaden +24 schwerwiegende Erkrankungen/100 Frauen
[Jede 4. Frau, die eine Langzeitbehandlung mit Hormonen durchführt, muss mit einer zusätzlichen schwerwiegenden Erkrankung rechnen] - Verlust (an krankheitsfreien Jahren): Schaden -5,5 Jahre
[Jede Frau, die eine Langzeitbehandlung mit Hormonen durchführt, muss mit 5,5 zusätzlichen Krankheitsjahren im Laufe ihres Lebens rechnen]
Auch bei nur relativ kurzer Behandlungsdauer z. B. von 5 Jahren muss mit einer schweren Erkrankung in 3 von 100 Fällen gerechnet werden. D. h. jede Frau, auch wenn sie nur eine Hormonbehandlung bis zu 5 Jahre nach der Menopause erhält, muss damit rechnen, dass sie 1 – 1,5 gesunde Lebensjahre verliert:
Netto-Bilanz (5 Jahre Behandlung ab 50a):
- 5-Jahres-Risiko: Schaden +3,18 schwerwiegende Erkrankungen/100 Frauen
[3 von 100 Frauen, die 5 Jahre unmittelbar nach der Menopause mit Hormonen behandelt werden, bekommen eine zusätzliche schwerwiegende Erkrankung] - Verlust (an krankheitsfreien Jahren): Schaden -1,22 Jahre
[Jede Frau, die eine Hormonbehandlung bis zu 5 Jahre bekommt, muss damit rechnen, dass sie 1,22 Jahre zusätzlich ernstlich krank ist]
Generell kann also gesagt werden, dass bei einer Hormonersatztherapie (kurzfristig oder als Langzeittherapie) immer mit einem erheblichen Schadensrisiko gerechnet werden muss. Sie sollte daher, wo immer es geht, vermieden werden (Entmedikalisierung). Bei Wechselbeschwerden müssen diese schon sehr ausgeprägt sein (z. B. Arbeitsunfähigkeit), wenn die schädliche Wirkung einer (auch nur kurzfristigen) Hormontherapie zugunsten einer besseren Lebensqualität in Kauf genommen werden soll. Auch hier ergeben sich Ressourceneinsparungen in Milliardenhöhe.
Schlussfolgerung: Nutzen der Sinnorientierten Medizin (S.O.M.)
Der primäre Nutzen des vorgelegten Konzepts einer Sinnorientierten Medizin (S.O.M.) besteht darin, die vorhandenen wissenschaftlichen Daten (EBM) für den praktisch tätigen Arzt so transparent zu gestalten, dass sinnlose Therapiemaßnahmen verhindert und die vorhandenen therapeutischen und ökonomischen Möglichkeiten für den Patienten optimal einsetzbar werden. Wie gesagt:
Rationalisierung statt Rationierung
Effizienz statt Verschwendung
Sinnvolle Ressourcenverteilung
Nutznießer der vorgelegten Methode könnten sein:
1. Der mündige Patient:
Durch die Transparenz der Daten kann eine offene und gemeinsame Entscheidungsfindung für eine sinnvolle und effektive Behandlungsstrategie genau definiert werden.
2. Der Arzt:
Für den Arzt, der heute durch eine zum Teil überbordende Datenflut verunsichert und teilweise unter einen kollektiven Handlungs- und Behandlungszwang gestellt wird, bringt die S.O.M. eine Vereinfachung und Erleichterung seines ärztlichen Tuns im Sinne einer individuellen patientenorientierten Medizin.
3. Arzneimittelkommissionen in Krankenhäusern:
Auch für die nun gesetzlich verankerten Arzneimittelkommissionen in Krankenanstalten kann die S.O.M.-Berechnungsmethode eine wertvolle Entscheidungshilfe sein.
4. Die Zulassungsbehörde:
Den Gremien, die für die Zulassung von Medikamenten verantwortlich sind, können hilfreiche Entscheidungskriterien geliefert werden.
5. Die Krankenkassen:
Auch den Krankenkassen können Argumente bzw. sinnvolle Kriterien für Bewilligungen von Medikamenten, diagnostischen Maßnahmen, Therapiekonzepten usw. zur Verfügung gestellt werden.
6. Die Gesundheitspolitik:
Weiters soll auch eine begründbare Rationalität bei der Verteilung der verfügbaren Ressourcen erreicht werden, sodass die Einsparung von unnötigen Kosten letztlich zu einer besseren gesundheitlichen Betreuung der Gesamtbevölkerung führt.
7. Die pharmazeutische Industrie:
Für die pharmazeutische Forschung sind die Kriterien der S.O.M. insofern von erheblicher Bedeutung, als sich Entscheidungen für neue Entwicklungen am Medikamentensektor nicht nur am potentiellen Markt, sondern auch an deren Relevanz für den Patienten orientieren sollten.
8. Die medizinische Wissenschaft:
Die Zielrichtung der klinischen Forschung könnte insofern beeinflusst werden, als sie sich mehr an den Bedürfnissen des Patienten orientieren sollte. Insbesondere müsste sie sich stärker mit der Problematik der Nebenwirkung in einer Therapie und vorrangig mit der Verbesserung der Lebensqualität durch eine Behandlung auseinandersetzen, während die Erreichung von marginalen Erfolgen zur Lebensverlängerung zweitrangig wäre.
Referenzen
- Fischer M. R., Bartens W., Zwischen Erfahrung und Beweis. Medizinische Entscheidungen und Evidence-based Medicine, Verlag Hans Huber, Bern 1999
- Bonelli J. et al., Medical care concepts beyond evidence based medicine: Decision making modeling of lifetime gain with cost benefit analysis for individual patients, Int J Clin Pharmacol Ther (2004); 42: 680-689
- Downs J. R. et al., Primary Prevention of Acute Coronary Events With Lovastatin in Men and Women With Average Cholesterol Levels, JAMA (1998); 279: 1615-1622
- Bobbio M., Demichelis B., Giustetto G., Completeness of reporting trial results: effect on physicians’ willingness to prescribe, Lancet (1994); 343: 1209-1211
- Long-term Intervention Within Pravastatin in Ischaemic Disease (LIPID) Study Group, Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels, N Engl J Med (1998); 339: 1349-1357
- Toplak H., Aktion: „Werte für das Leben", Forum Lipid austriacum, Aussendung vom Oktober 2001
- Bonelli J. et al., Medical care concepts beyond evidence based medicine: Decision making modeling of lifetime gain with cost benefit analysis for individual patients, Int J Clin Pharmacol Ther (in Druck)
- Bonelli J., Prat E., Felsenstein K., S.O.M. Sinnorientierte Medizin. Eine Methode zur Risiko-/Nutzen-Analyse medizinischer Maßnahmen am Beispiel der Hormonersatztherapie und der Osteoporosebehandlung, Fonds „Gesundes Österreich", Wien 2003
- World Health Organization, The World Health Report 2002: Reducing Risks, Promoting Healthy Life, WHO, Genf 2002
- Hakim A. A. et al. (1998), Effects of walking on mortality among nonsmoking retired men, N Engl J Med (1998); 338: 94-99
- Calle E. E. et al., Body-Mass Index and Mortality in a Prospective Cohort of U. S. Adults, N Engl J Med (1999); 341: 1097-1105
- Bonelli J., Wie relevant ist die Statintherapie für die klinische Praxis?, WMW (2003); 153: 260-263
- Cohen B. L., Lee I. S., A catalog of risks, Health Phys (1979); 36: 707-722
- Lauer M. S., Aspirin for Primary Prevention of Coronary Events, N Engl J Med (2002); 346: 1468-1474
- Stampfer M. J. et al., Primary Prevention of Coronary Heart Disease in Women through Diet and Lifestyle, N Engl J Med (2000); 343: 16-22
- Grover S. A. et al., The Benefits of Treating Hyperlipidemia to Prevent Coronary Heart Disease, JAMA (1992); 267: 816-822
- Detsky A. S., Naglie I. G., A clinician’s guide to cost-effectiveness analysis, Ann Intern Med (1990); 113: 147-154
- Rella W., Anwendung von S.O.M. bei unheilbaren primären Gehirntumoren, Imago Hominis (2004); 11: 265-276
- Stupp R. et al., Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide, J Clin Oncol (2002); 20: 1375-1382
Fazeny-Dörner B. et al., Survival with dacarbazine and fotemustinne in newly diagnosed glioblastoma multiforme, Br J Cancer (2003); 88: 496-501 - Die Berechnung basiert auf der in der Literatur belegbaren Annahme, dass die mediane Überlebenszeit durch eine adjuvate Chemotherapie gegenüber Chirurgie + Radiotherapie alleine ca. um 10%, d. h. um ca. 2 Monate (= 10% von 20 Monaten) verlängert werden kann (vgl. TMZ-Studie, Seite 8).
- Cummings S. R. et al., Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures. Results from the Fracture Intervention Trial, JAMA (1998); 280: 2077-2082
- Daten nach Kiel D. P. et al. (1987), Hip Fracture and the Use of Estrogens in Postmenopausal Women (The Framingham Study), N Engl J Med 317: 1169-1174; Ringertz H. et al. (1997), Bone Density Measurement – A Systematic Review. A Report from SBU, the Swedish Council on Technology Assessment in Health Care, J Intern Med 241: Suppl 739; Schürch M.-A. et al. (1996), A Prospective Study on Socioeconomic Aspects of Fracture of the Proximal Femur, J Bone Miner Res 11: 1935-1942; Melton L. J. et al. (1992), How many women have osteoporosis?, J Bone Miner Res 7: 1005-1010; Cummings S. R., Melton L. J. III (2002), Epidemiology and outcomes of osteoporotic fractures, Lancet 359: 1761-1767; Black D. M. et al. (1996), Randomised Trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group, Lancet 348: 1535-1541
Prim. Univ.-Prof. Dr. Johannes Bonelli, IMABE-Institut
Landstraßer Hauptstraße 4/13, A-1030 Wien
bonelli(at)imabe.org