Kriterien für den Nutzen einer Therapie (S.O.M)
Univ.-Prof. Dr. Johannes Bonelli
Stand: Jänner 2005
Ärzte sind heute mit einer immer unüberschaubareren Menge an statistisch aufgearbeiteten Daten konfrontiert, die eine Vielzahl von Anforderungen an sie herantragen. Der Arzt möchte seinem Patienten die dem modernen Wissenstand entsprechende Therapie zukommen lassen. Doch nicht immer ist es das Verantwortungsgefühl, das den ausschlaggebenden Faktor im Rahmen einer Therapieentscheidung ausmacht. Auch eine gewisse Furcht vor Regressansprüchen von Seiten der Patienten und ihrer Angehörigen oder auch finanzielle Überlegungen können auf die Entscheidung Einfluss nehmen. Als wesentliches Kriterium gilt hierbei - vor allem in Anbetracht der immer zahlreicheren und nicht selten auch teureren Therapieansätze sowie des zunehmenden Altersdurchschnitts unserer Gesellschaft - die Abschätzung von Relevanz und Sinnhaftigkeit einer Therapie zu beachten.
Eine ärztliche Maßnahme erscheint vor allem dann sinnvoll, wenn sie dem individuellen Patienten in seiner Gesamtheit nützt.
Eine ärztliche Maßnahme erscheint nicht schon dann sinnvoll, wenn sie in einem Einzelaspekt als wirksam belegt ist, sondern erst dann, wenn sie dem Patienten in seiner Gesamtheit nützt. Dies ist die grundsätzliche Aussage der so genannten Sinnorientierten Medizin (S.O.M.). Die Verwendung moderner wissenschaftlicher (meist aus großangelegten randomisierten Multicenterstudien gewonnener) Daten hilft nicht nur, Kenntnisse nach Art der Evidence Based Medicine zu erwerben; sie ermöglicht es auch, einen gezielten, dem Patienten individuell angepassten Einsatz diagnostischer und therapeutischer Maßnahmen für die Praxis zu leiten.
Zu diesem Zweck wird die Verhältnismäßigkeit der jeweiligen ärztlichen Maßnahme in drei Stufen beurteilt: zunächst ihr qualitativer Nutzen, dann der quantitative Nutzen und schließlich der praktische oder individuelle Nutzen diagnostischer und therapeutischer Handlungen.
1. Qualitativer Nutzen
Der qualitative Nutzen einer Handlung wird vor allem an den drei klassischen hippokratischen Kriterien gemessen, nämlich an Heilung, Lebensverlängerung und Leidenslinderung. Wenn das ärztliche Handeln diese prinzipiellen Zwecke erfüllt, kann es als wirksam und sinnvoll bezeichnet werden. Oder besser formuliert: die Erreichung wenigstens einer dieser drei Vorgaben ist unabdingbare Voraussetzung für eine sinnvolle Behandlung.
Beispiel: Jahrzehntelang galt als Kriterium für die Beurteilung der Wirksamkeit und Effektivität einer antiarhythmischen Therapie die EKG-Kurve. Erst in den letzten Jahren konnte schließlich gezeigt werden, dass durch diese Medikamente zwar die Rhythmusstörungen des Herzens behoben werden konnten, sich damit aber die Lebensqualität nicht verbessern ließ. Es wurde sogar gezeigt, dass die Lebenserwartung dieser Patienten zum Teil durch die Therapie verkürzt wurde.1
2. Quantitativer Nutzen
In der Beurteilung einer ärztlichen Handlung reicht es nicht allein aus, die drei Zielparameter Heilung, Lebensverlängerung und Lebensqualität aus qualitativer Perspektive ins Auge zu fassen. Um zu entscheiden, ob im Einzelfall eine Therapie wirklich sinnvoll ist, gilt es, Wirkung und Nebenwirkung einer Therapie möglichst genau zu quantifizieren. Dies geschieht durch die so genannte Relevanzanalyse, welche sowohl die Ansprechrate auf die Behandlung, das Ausmaß der Lebensverlängerung und der Verbesserung der Lebensqualität als auch das Ausmaß der Nebenwirkungen (Toxizität) berücksichtigt. Dabei gilt es zu Beginn, vor allem die beiden Begriffe der relativen und der absoluten Risikoreduktion auseinander zu halten. Die relative Risikoreduktion bezeichnet, um wie viel Prozent das Risiko in einer Behandlungsgruppe für ein bestimmtes Ereignis durch die Behandlung im Verhältnis zum als 100% gesetzten Risiko einer Kontrollgruppe reduziert wird. Beträgt beispielsweise in der Kontrollgruppe das Risiko für ein Ereignis 5% und in der Behandlungsgruppe 4%, so beträgt die relative Risikoreduktion 20%, was bedeutet, dass in der Interventionsgruppe im Vergleich zur Kontrollgruppe Ereignisse um 20% (1 – 4/5 = 0,20) seltener sind. Hingegen bezeichnet die absolute Risikoreduktion die absolute Differenz der Ereignisrate zwischen den beiden Vergleichsgrupen. Das wäre beispielsweise bei einem Risiko von 5% in der Kontrollgruppe und einem Risiko von 4% in der Interventionsgruppe eine absolute Risikoreduktion von 1%. Dies sei im Folgenden an einem konkreten Beispiel einmal veranschaulicht.
Bei bloßer Betrachtung der so genannten relativen Risikoreduktion kann es zu einer kapitalen Fehleinschätzung der Relevanz bestimmter Therapien kommen.
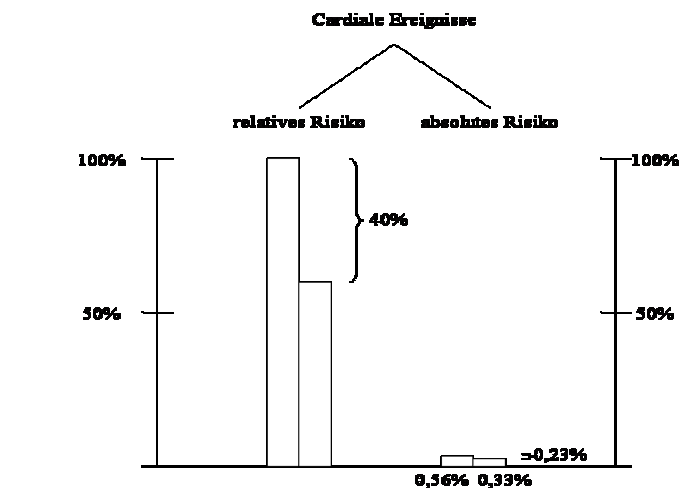
Beispiel: Nach der CARE-Studie2 könne das relative Risiko eines tödlichen Herzinfarktes in der Sekundärprävention durch den Einsatz von Statinen um 37% gesenkt werden (Abbildung I). Absolut gesehen wird die Sterberate an einem tödlichen Herzinfarkt in 5 Jahren Therapiedauer von 1,8% auf 1,2%, und somit um 0,6%, gesenkt. Dies bedeutet eine Reduktion des absoluten Risikos pro Jahr um 0,12%, also um ca. 1 Promille.
So zeigt sich, dass die Senkung eines relativen Risikos nichts über die therapeutische Relevanz einer Behandlung aussagt. Bei bloßer Betrachtung der sog. relativen Risikoreduktion kann es somit zu einer kapitalen Fehleinschätzung der Relevanz bestimmter Therapien kommen. Dies gilt es vor allem dann zu berücksichtigen, wenn Daten für die Einführung neuer Medikamente oder neuer Therapieformen präsentiert werden. Es konnte im Rahmen von Studien beobachtet werden, dass Ärzte viel eher geneigt sind, ein Medikament zu verschreiben, wenn ihnen nur die relativen Risikozahlen einer Studie präsentiert werden, als wenn die Ergebnisse derselben Studie in absoluten Zahlen angegeben werden.3
Ein in diesem Kontext häufig verwendeter Begriff ist derjenige der so genannten Number Needed to Treat (NNT): Hiermit wird recht gut die Ansprechrate auf eine Therapie erfasst. Sie gibt die Anzahl von Patienten an, die behandelt werden müssen, damit der erwünschte Therapieeffekt in einem gewissen Zeitraum eintritt. In unserem Beispiel beträgt die NNT 1000:1, das bedeutet, dass bei einer Behandlung von 1000 Patienten über eine Therapiedauer von einem Jahr ein Herzinfarkt verhindert werden kann. Bei anderen Therapien beträgt die NNT je nach Zielparameter zum Beispiel 1:1 beim Typ I-Diabetes, ebenso 1:1 bei der Pneumonie, 833:1 für Schlaganfall bei milder Hypertonie. Und doch reicht die NNT nicht aus, um die Effektivität einer Therapie richtig einzuschätzen, denn sie sagt nichts darüber aus, ob ein Ereignis gänzlich verhindert oder nur hinausgeschoben werden kann.
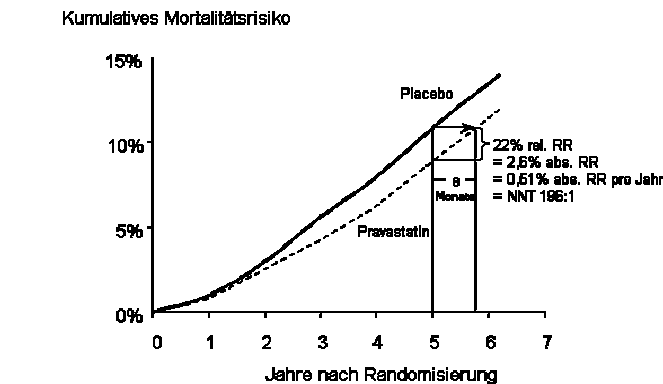
Ein weiteres Augenmerk muss auf das Ausmaß der Lebensverlängerung bzw. die Verbesserung der Lebensqualität gelegt werden: Dass durch eine medikamentöse Therapie immer einschneidende Ereignisse oder gar der Tod verhindert und somit Menschenleben gerettet werden können, ist meist eine nur wenig aufrichtige Aussage. Betrachtet man etwa die kumulativen Mortalitätskurven aus der LIPID-Studie4 (Abbildung II), so erkennt man mit Leichtigkeit, dass der so viel gepriesene „rettende Effekt“ einer Statintherapie eigentlich weniger einer Lebensrettung bzw. Infarktverhinderung als doch viel mehr nur einer Lebensverlängerung entspricht. K. Felsenstein entwickelte hierzu gemeinsam mit J. Bonelli einen mathematischen Algorithmus, mit dessen Hilfe man die durchschnittliche Lebensverlängerung oder Ereignisverzögerung durch Medikamente berechnen kann.5
Zeigt eine Therapie Wirksamkeit, so gilt es, die Wirkung zu quantifizieren und die Relevanz der Therapie unter Berücksichtigung von therapie-assoziierter Toxizität und Risken zu beurteilen.
Hierbei muss auch die altersbezogene Mortalitätsrate in die Überlegungen einbezogen werden: bei 85-jährigen Männern beträgt die jährliche Mortalitätsrate in der allgemeinen Bevölkerung etwa 15%, eine absolute Risikoreduktion von 0,5% scheint hierbei vernachlässigbar, während dieselbe Risikoreduktion bei einer 50-jährigen Frau mit einer jährlichen Mortalitätsrate von 0,6% in dieser Altersklasse durchaus zu beachten ist. So kann generell angenommen werden, dass für eine gegebene absolute oder relative Risikoreduktion die Effektivität der jeweiligen Therapie mit zunehmendem Alter abnimmt, aus dem einfachen Grund, dass die Gesamtmortalität in der allgemeinen Bevölkerung dramatisch mit der Zeit zunimmt.
Nach Abschätzung der erreichbaren Lebensverlängerung bzw. -qualität müssen auch die Nebenwirkungen anhand eines Toxizitätsindexes quantifiziert werden, um beides gegeneinander abwägen zu können. Erst daraus ergibt sich die Relevanz, d. h. der wirkliche Nutzen einer Therapie. Je niedriger das absolute Risiko bei nur geringfügiger Lebensverlängerung, desto weniger dringlich wird die Behandlung und desto größer die Wahrscheinlichkeit, durch die Therapie mehr zu schaden als zu nützen. Wenn daher bei einer kaum effektiven Therapie relevante Nebenwirkungen und Unverträglichkeiten durch die Behandlung auftreten, so kann sicherlich ruhigen Gewissens auf die Weiterbehandlung verzichtet werden.
3. Praktischer oder individueller Nutzen
Hierbei geht es um Merkmale, die den konkreten Patienten charakterisieren: objektive Faktoren wie Alter, Bewusstseinslage, Lebenserwartung, menschliches Umfeld und sonstige persönliche Daten sowie subjektive Kriterien wie Wertvorstellungen, Präferenzen, Interessen und Zielvorstellungen.
Es ist evident, dass randomisierte Studien in erster Linie bloß statistische Aspekte einer medizinischen Maßnahme reflektieren und nicht unüberlegt und direkt den einzelnen Patienten betreffen. Der individuelle Patient profitiert nicht unbedingt vom Wissen um eine 30%-ige Mortalitätsreduktion. Die wesentliche Frage ist diejenige, wie man die Interpretation großer Datenmengen von klinischen Studien so verbessern kann, dass die daraus gewonnene Information auf sinnvolle Weise in den komplexen Entscheidungsfindungsprozess im Rahmen der medizinischen Betreuung des einzelnen Patienten integriert werden kann.
Um die Kluft zwischen dem statistischen Nachweis von Vorteilen bestimmter Therapien und den Anforderungen des klinisch-medizinischen Alltags zu überbrücken, zeigt sich die Berechnung der erreichbaren Hinauszögerung eines geeigneten Endpunktes sinnvoll, um Verallgemeinerungen aus den Ergebnissen einer klinischen Studie für die Entscheidungsfindung in der medizinischen Praxis zu treffen. Dabei werden sowohl das Grundrisiko eines Patienten als auch die Risikoreduktion und die individuelle Lebenserwartung miteinbezogen; der Faktor selbst reflektiert schließlich den erwarteten ereignisfreien Lebenszeitgewinn (event-free lifetime gain = EELG) in Zusammenhang mit der erwarteten ereignisfreien Lebenszeit (expected event-free lifetime = EEL) für den individuellen Patienten.6 Dies kann auch ein nützliches Werkzeug für die Erfassung von Vor- und Nachteilen einer spezifischen Therapie sein, wobei dies auch die Berechnung der QUALYs (quality-adjusted life years) umfasst, ein Begriff, in dem Effekte und Lebensqualität miteinbezogen sind.7
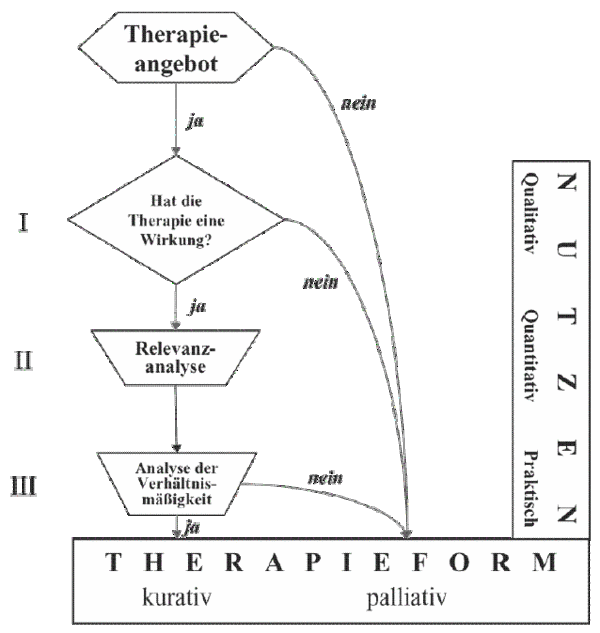
Nach Betrachtung der vorangegangenen Faktoren macht es Sinn, für jegliche Therapieentscheidung nach dem so genannten S.O.M.-Stufenplan vorzugehen (Abbildung III):8 zunächst muss die Therapieoption auf ihre Wirksamkeit hin untersucht werden, nach den Kriterien der Evidence-based Medicine. Zeigt die Therapie eine Wirksamkeit, so gilt es, die Wirkung zu quantifizieren und die Relevanz der Therapie unter Berücksichtigung von therapie-assoziierter Toxizität und Risiken zu beurteilen. Schließlich wird nach Durchführung einer Verhältnismäßigkeitsanalyse entschieden, ob eine spezifische Therapieform für den konkreten Patienten sinnvoll und hilfreich ist.
Mit Hilfe dieser Methode können die therapeutischen Möglichkeiten der modernen Medizin rational, effizient und sinnvoll für den individuellen Patienten genutzt werden.
Referenzen
- Roden D. M., Risks and Benefits of Antiarrhythmic Therapy, N Engl J Med (1994); 331: 785-791
- (The CARE Trial Investigators), The Effect of Pravastatin on Coronary Events after Myocardial Infarction in Patients with Average Cholesterol Levels, N Engl J Med (1996); 335: 1001-1009
- Bobbio M., Demichelis B., Giustetto G., Completeness of reporting trial results: effect on physicians’ willingness to prescribe, Lancet (1994); 343: 1209-1211
- Long-term Intervention within Pravastatin Ischemic Disease (LIPID) Study Group, Prevention of Cardiovascular Events and Death with Pravastatin in Patients with Coronary Heart Disease and a Broad Range of Initial Cholesterol Levels, N Engl J Med (1998); 339: 1349-1357
- Bonelli J., Prat E. H., Felsenstein K., S.O.M. Sinnorientierte Medizin. Eine Methode zur Risiko-/Nutzen-Analyse medizinischer Maßnahmen am Beispiel der Hormonersatztherapie und der Osteoporosebehandlung, Fonds „Gesundes Österreich“, Wien 2003
- Bonelli J., Prat E. H., Sinnorientierte Medizin (S.O.M.). Paradigmawechsel in der Medizin: von der Machbarkeit zur Sinnhaftigkeit – Medizin für den Einzelfall, Imago Hominis (1999); 187-207
Bonelli J. et al., Medical care for individual patients: concepts beyond evidence-based medicine, Int J Clin Pharmacol Ther (2004); 42: 680-689 - Detsky A. S., Naglie J. G., A clinician’s guide to cost-effectiveness analysis, Ann Intern Med (1990); 113: 147-154
- Bonelli J., Sinnorientierte Medizin, Imago Hominis (2004); 11: 251-264