Anwendung von S.O.M. bei unheilbaren primären Gehirntumoren
Zusammenfassung
Temozolomide (Temodal®, Schering) ist ein neuartiges alkylierendes Zytostatikum, das seit 5 Jahren für die Behandlung bösartiger primärer Gehirntumore zugelassen ist. Die vorliegende Studie überprüft nach den Kriterien von S.O.M. (Sinnorientierte Medizin) die Wirksamkeit, Risiken und Kosten von Temodal® im Vergleich zu etablierten alternativen Chemotherapien. Es zeigt sich an Hand detaillierter Berechnungen, dass trotz einer messbaren Verbesserung der Lebensqualität und einer geringfügigen Lebensverlängerung die adjuvante Verabreichung von Temodal® als first line-Therapie bei bösartigen primären Gehirntumoren aufgrund eines sowohl internen wie auch externen Vergleiches nicht gerechtfertigt werden kann.
Schlüsselwörter: Glioblastom, Chemotherapie, Temodal®, S.O.M.-Analyse, Konsteneffizienz
Abstract
Temozolomide (Temodal®, Schering) is a new alkylating cytostatic agent, which has been approved for the treatment of malignant primary tumors of the brain. The present study investigates, following the criteria of S.O.M. (Sense Oriented Medicine), benefits, risks and costs of Temodal® as compared to established alternative chemotherapies. It is shown by detailed calculations using internal and external standards, that despite measurable benefits on quality of life and a marginal prolongation of survival, Temodal® cannot be recommended for use as a first line adjuvant treatment for primary malignant brain tumors.
Keywords: Glioblastoma, Chemotherapy, Temodal®, S.O.M.-Analysis, Cost Efficiency
Einleitung: GBM, eine tödliche Erkrankung. Ihre bisherige Behandlung
Glioblastoma multiforme (GBM) ist die häufigste und bösartigste Form primärer Gehirntumore. Sie tritt mit einer Inzidenz von 1/10.000 pro Jahr auf und kann jedermann in jedem Lebensalter befallen. Unbehandelt oder nur chirurgisch palliativ behandelt, liegt die Mediane Überlebenszeit (MedÜZ) der Erkrankten unter 6 Monaten. Dabei folgt die Absterbenskurve, wie für wachstumsabhängige Prozesse typisch, dem natürlichen Logarithmus. Das heißt, im großen Kollektiv betrachtet sterben die meisten Erkrankten innerhalb eines halben Jahres, während einige wenige auch länger als 2 Jahre überleben können.
Durch Anwendung von Radiotherapie (Ganzhirnbestrahlung mit 60Co) konnte die MedÜZ auf das Doppelte verlängert werden. Zur Minimierung von Kollateralschäden (Gehirnödem, Radionekrose und Demenz in der Folge) wird heute eine MR-gezielte lokale oder eine postchirurgisch fokale Radiotherapie (Brachytherapie mit 131J) angewandt. Bei Einsatz letzterer Maßnahme kann die MedÜZ bei GBM nochmals um 1/3 verlängert werden.1 Die Lebensqualität der so Behandelten ist in der Regel gut. Erst wenn der Tumor, wie leider unausweichlich, neuerlich fortschreitet, wird die typische Symptomatik (Kopfschmerzen, epileptische Anfälle, neurologische Ausfälle) und mit ihr auch der psychische Leidensdruck wieder manifest.
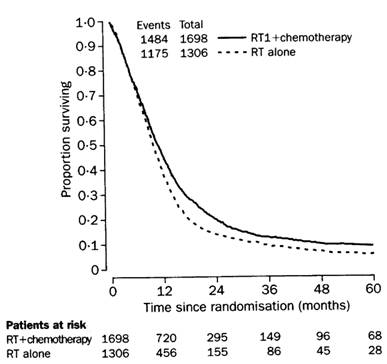
Innerhalb der letzten Jahrzehnte wurde nach dem Beispiel vieler anderer Krebserkrankungen (Mammakarzinom, Bronchuskarzinom, Colonkarzinom etc.) auch beim GBM eine postchirurgische, postradiotherapeutische sog. adjuvante Chemotherapie eingeführt. Als Standardtherapeutika gelten seit 1970 die alkylierenden Nitrosourea-Präparate BCNU (Carmustin intravenös) und CCNU (Lomustin peroral). Seit 1985 wird auch das besser liquorgängige Fotemustin angewandt. Weitere erprobte Mittel sind die ebenfalls alkylierend wirkenden Carbazine MTIC (Procarbazin) und DTIC (Dacarbazin), sowie der Mitosehemmer Vincristin. Mit diesen Chemotherapeutika, allein oder in Kombination in Form einer Polychemotherapie, konnte die MedÜZ bei hochmalignen primären Gehirntumoren um bescheidene 10% gegenüber Chirurgie plus Radiotherapie verlängert werden.2 Eine einschlägige Metaanalyse über die Wirksamkeit dieser Substanzen bei über 2000 neu diagnostizierten Fällen bringt Tabelle I. Eine weitere, neuere Metaanalyse mit insgesamt 3000 Patienten weist dem gegenüber einen durchschnittlichen Überlebensgewinn nach 12 Monaten von sogar nur 6% aus, der auf Grund des großen Kollektivs aber hochsignifikant war.3 Wie Abbildung I aus der Arbeit der GMT-Gruppe zeigt, beträgt die Lebensverlängerung in der Regel nur wenige Tage bis Wochen und nur ein geringer Prozentsatz der Erkrankten profitiert von der Behandlung über einen längeren Zeitraum.
| Therapie | Überleben | |||
|---|---|---|---|---|
| nach 6 Monaten | nach 12 Monaten | nach 18 Monaten | nach 24 Monaten | |
|
RT allein (conf. limits) |
77,9% (74,1 - 81,7) |
43,1% (40,4 - 45,8) |
21,6% (18,6 - 24,6) |
16,4% (13,3 - 19,5) |
| RT + Chemotherapie |
82,6% (79,6 - 85,6) |
53,2% (50,7 - 55,5) |
32,5% (29,5 - 35,5) |
25,0% (21,9 - 28,1) |
| Differenz | 4,7% | 10,1% | 10,9% | 8,6% |
| Relative Differenz | 6,0% | 23,4% | 50,5% | 52,4% |
Die Nebenwirkungen dieser bisher geübten adjuvanten Chemotherapie sind erheblich. Zu den noch gut kontrollierbaren Nebenwirkungen wie Übelkeit, Erbrechen und Haarausfall gesellen sich Blutbildschäden, die zu schweren Infektionen und Blutungen (mit notwendigen Hospitalisationen) bis hin zum Tode führen können. Es ist daher wenig verwunderlich, dass die adjuvante Chemotherapie bei GBM, in Anbetracht auch ihrer geringen Wirksamkeit, immer umstritten war.
I Temodal®: eine innovative Chemotherapie. Evidenz ihrer Wirksamkeit und neue Fragen
Im letzten Jahrzehnt drängt ein neues Chemotherapeutikum – Temozolomide (TMZ) auf den Markt, welchem nachgesagt wird, es sei in der adjuvanten Therapie von GBM besser wirksam und in geringerem Maße nebenwirksam als die herkömmlichen Mittel. In der Tat weist TMZ gegenüber anderen vergleichbaren Mitteln eine Reihe von Vorteilen auf.4 TMZ (N-methyl-metozolomid) ist ein säurestabiles und lipophiles Vorläufermolekül von MTIC. Es ist daher oral administrierbar, praktisch zu 100% bioverfügbar, und kann die Blut-Hirn-Schranke gut passieren. Es zerfällt unabhängig von hepatischen Enzymen im basischen Milieu (des Tumors) in das aktive Radikal und andere harmlose harnpflichtige Substanzen. Das aktive Prinzip reichert sich daher im Tumor an ohne in anderen Geweben zu kumulieren. Wie alle Alkylantien wirkt TMZ durch die Methylierung der genetischen Substanz, was zu einer Anhäufung von Mutationen, zu Chromosomenbrüchen und schließlich zum Zelltod führt. Dieser Prozess durchschreitet eine Phase, in welcher die Tumorzellen dazu angeregt werden, aus dem Tumor lokal auszuschwärmen. Infolgedessen steigert TMZ vorübergehend leider auch die lokale Ausbreitung des Tumors.
TMZ befindet sich derzeit in der Phase III-Erprobung, das heißt, man prüft nach den Kriterien der Evidence Based Medicine (EBM) in entsprechend kontrollierten Studien, ob die erwartete bessere Wirksamkeit im Vergleich mit anderen Mitteln statistisch nachweisbar ist. Die „bessere Wirksamkeit" wird dabei nicht nur für den Endpunkt einer Lebensverlängerung, sondern – zurecht – auch für den Endpunkt einer verbesserten Lebensqualität (LQ) geprüft. Unbeschadet dessen wurde TMZ, nachdem in Phase I- und II-Erprobungen seine tolerable Toxizität und ausreichende Wirksamkeit erwiesen war, im Jahre 1999 von der Europäischen Union zur Behandlung von Glioblastoma multiforme zugelassen und seither unter dem Firmennamen Temodal® (Schering) in österreichischen Kliniken intensiv als neuer Therapiestandard für diese Indikation beworben. Selbstverständlich hat ein solch „fortschrittlicher neuer Standard" auch seinen Preis.
In dieser Situation, in welcher die Firma Schering und von ihr unterstützte Institutionen das Szenario eines unverzichtbaren Therapiefortschritts aufgebaut hatten, hat Imabe die Frage untersucht, ob bzw. unter welchen Voraussetzungen nach den Kriterien von S.O.M.5 die Anwendung von Temodal® zur adjuvanten Behandlung von Patienten mit GBM gerechtfertigt erscheint.
In einer Zeit angespannter Budgetmittel und ausufernder Gesundheitsausgaben in fast allen Ländern der Europäischen Union stellen sich viele Regierungen die Frage, welche Aufgaben die Gesellschaft für die Gesundheit ihrer Bürger übernehmen und welche Ausgaben sie dafür leisten will. Mit der bloßen Registrierung einer Arznei ist ja noch keinesfalls die Frage beantwortet, ob gewisse statistisch signifikante Vorteile für den Patienten tatsächlich relevant sind und ob sie für den Einzelnen bzw. für die Gesellschaft die Kosten rechtfertigen. Die mannigfachen Interessenskonflikte im Gesundheitswesen – Zwänge der Kosteneffizienz auf Seite der Spitäler, Zwänge des Verkaufserfolgs auf Seite der Pharmafirmen, Zwänge der beruflichen Karriere auf Seite der Ärzte – lassen die Interessen des Patienten, welche den Mittelpunkt des Gesundheitswesen bilden sollten, zunehmend in den Hintergrund treten. Aus diesem Grunde wurde in Großbritannien eine Institution – NICE (National Institute of Clinical Excellence) – geschaffen, welche unabhängig von der Arzneimittelregistrierung Empfehlungen für das National Health Service abgibt, ob und für welche Indikation ein bestimmtes registriertes Arzneimittel eingesetzt werden soll. Die Tätigkeit dieser Institution entspricht damit in etwa der Prüfung auf Kassenzulässigkeit in unserem Land, ihre Empfehlung ist jedoch – im Gegensatz zu Österreich – auch für die öffentlichen Spitäler bindend. Anders als S.O.M. berücksichtigt der NICE-Prozess nur den ökonomischen Aspekt und lässt Fragen der Lebensqualität unbeachtet.
II Übergang von der Evidenz (EBM) zur Relevanz
Für den Wirksamkeitsnachweis eines Arzneimittels genügt der Nachweis positiver statistisch signifikanter Unterschiede zwischen Behandlungsgruppe und Kontrollgruppe. Es ist aber bekannt, dass beliebig kleine derartige Unterschiede signifikant werden können, wenn genügend große und genügend homogene Gruppen verglichen werden. Entsprechend sind Studien von ihrer Größe und Zusammensetzung her meist so geplant, dass ein statistisch signifikantes Ergebnis erwartet werden kann. Es kann auch sein, dass eine statistische Signifikanz nur für einen bestimmten Endpunkt hervortritt, zum Beispiel für die Länge eines progressionsfreien Intervalls, nicht aber hinsichtlich einer Lebensverlängerung, welche für den Patienten gewiss von größerem Interesse wäre. Schließlich kann es auch sein, dass ein signifikant positives Ergebnis, z. B. eine Lebensverlängerung, durch negative Begleiteffekte oder Nebenwirkungen erkauft wird, welche in Summe den Wert des positiven Ergebnisses egalisieren oder gar ins Gegenteil verkehren.
Eine sinnorientierte Medizin darf sich nicht mit Surrogaterfolgen begnügen oder bei bloß statistischen Erwägungen stehen bleiben, sondern muss fragen, inwieweit bestimmte Parameter und Zahlenwerte den Wünschen und Interessen des Patienten entgegenkommen. Entsprechend wurde in der vorliegenden Studie auf folgende Parameter Bedacht genommen:
1. Es wurde als erster Endpunkt die Überlebenszeit herangezogen. Dies nicht nur deshalb, weil sie für den Patienten am relevantesten ist, sondern auch deshalb, weil sie unzweifelhaft feststeht. Die Beurteilung des progressionsfreien Intervalls hingegen ist vom Untersucher und von der Untersuchungsmethode abhängig. Nicht-verblindete multizentrische Studien sind hinsichtlich dieses Endpunktes daher kaum verwertbar.
2. Es wurde als zweiter Endpunkt die Lebensqualität beurteilt. Besonders Studien aus neuerer Zeit schenken diesem Endpunkt gesonderte Beachtung. Für Patienten mit Krebserkrankungen im Allgemeinen und Patienten mit Gehirntumoren im Besonderen gibt es standardisierte, mithilfe eines Punktesystems quantitativ auswertbare Fragebögen betreffend die somatische, psychische und kognitive Befindlichkeit, aus welchen auf die Lebensqualität des Patienten insgesamt geschlossen werden kann. Da die Lebensqualität mit dem progressionsfreien Intervall korreliert, wird auch dieser Endpunkt indirekt miterfasst.
3. Als dritter Endpunkt wurde die therapiebezogene Lebensqualität beurteilt, das heißt, es wurden jene Parameter der Lebensqualität gesondert erfasst, welche nicht durch die Erkrankung an sich, sondern durch die Behandlung der Erkrankung aufgrund von deren Nebenwirkungen beeinträchtigt waren. Zu diesem Zweck wurde ein von 0 bis 1 graduierter Toxizitäts-Index (TI) berechnet, welcher sowohl die prozentuelle Häufigkeit als auch die Schwere der auftretenden Nebenwirkungen berücksichtigt. Für leichte Nebenwirkungen (Grad 1 oder 2, z. B. Erbrechen, Haarausfall) wurde die Prozentzahl mit dem Faktor 0,15, für schwere Nebenwirkungen (Grad 3 oder 4, z. B. Infektionen, hochgradige Thrombopenien) mit dem Faktor 0,35 und für Todesfälle auf Grund von Nebenwirkungen (z. B. Sepsis, massive Blutungen) mit dem Faktor 1 multipliziert und die Summe aller Produkte von 1 abgezogen. Auf diese Weise ergeben zum Beispiel 60% leichte Nebenwirkungen und 20% schwere Nebenwirkungen in Summe einen TI von 1 – (0,09 + 0,07) = 0,84.
4. Um Therapieeffekte hinsichtlich ihrer Auswirkung auf das Überleben kollektiv besser beurteilen zu können, wurde der punktuelle Parameter der Medianen Überlebenszeit – es handelt sich um den Zeitpunkt, da die Hälfte der Patienten verstorben ist – durch den Parameter der Integrierten Überlebenszeit (IntÜZ) ergänzt. Zu diesem Zweck wurde der Flächeninhalt der Überlebenskurve zwischen der X-Koordinate (Zeitachse) und der Y-Koordinate (Überlebenswahrscheinlichkeit) berechnet und die Größe dieser Fläche als %Gesamtfläche des Diagramms dargestellt. Wenn z. B. der Beobachtungszeitraum 24 Monate beträgt, dann besteht die Gesamtfläche aus 24 Einheiten. Die integrierte Kurve erfülle 30% der Gesamtfläche. Die IntÜZ beträgt daher 24 x 0,3 = 7,2 Monate. Die Vorteile dieser Berechnungsmethode bestehen darin, dass sie den gesamten Überlebenszeitraum berücksichtigt und Therapieeffekte, welche eine Abweichung von der Medianverteilung hervorrufen, erfasst werden können.
Mithilfe des Lebensqualitäts-Index (LQI) und des Toxizitäts-Index (TI) kann nun die Mediane oder Integrierte Überlebenszeit einer Behandlungsgruppe so korrigiert werden, dass daraus eine Größe für die qualitätsvolle Überlebenszeit resultiert, welche die Interessen und Wünsche des Patienten mit einbezieht und somit als relevante Überlebenszeit zur Geltung kommt. Die relevante Überlebenszeit wurde im Studienvergleich durch so genannte Qualy-Monate (Qualy = Quality Adjusted Life Years) erfasst und folgendermaßen definiert: Qualy (in fiktiven Monaten) = IntÜZ x LQI x TI. Aus dieser Kenngröße lassen sich weitere Wirksamkeitsparameter errechnen.6 Dazu zählen (1) der Qualy-Gewinn bzw. Qualy-Verlust: Er ist gleich der Differenz der Qualy von Behandlungs- und Kontrollgruppe und gibt an, wie viel qualitätsvolle Lebenszeit durch eine Therapie im Vergleich zu einer anderen gewonnen bzw. verloren wird. Weiters (2) die Effektivität (in %): Sie ist gleich dem Qualy-Gewinn x 100 bezogen auf die IntÜZ und gibt an, wie effektiv eine bestimmte Therapie ist. Eine 100%ige Effektivität ist dann gegeben, wenn 1 Monat Therapie mit 1 Monat Qualy-Überleben korreliert (das ist z. B. bei Dialysepatienten der Fall). Schließlich (3) der Gewinnfaktor: Er ist gleich dem Quotienten aus Qualy-Therapiegruppe und Qualy-Kontrollgruppe und gibt an, um wie viel die eine Therapie besser ist als die andere.
| Therapiearme |
TMZ 150mg/m2 x5/28d steig. bis max. 200mg |
PCB 125mg/m2 x28/56d steig. Bis max. 220mg |
|---|---|---|
| Fallzahl | 112 | 113 |
| Alter | 52 (21 - 76) | 51 (21 - 74) |
| KPS-Score | 80 (70 - 100) | 80 (70 - 100) |
| Vorbehandlung |
Resektion: 87% Biopsie: 13% Adj. BCNU: 65% |
91% 9% 68% |
| Intervall Dg.-Rez. | 7 Mo (3,1 - 66) | 8,4 Mo (2 - 92) |
|
Resultate: PFS (Mo) PFS 6 % lebend 6 mo 12 mo 18 mo MedÜZ IntÜZ (bis 18 Mo) |
3,0** 21%** 60% 23% 12% 7,5 8,03 |
2,0 8% 42% 20% 11% 6,0 7,16 |
|
Toxizität Grad 1-2 Grad 3/4 |
59% 18% (3% abgesetzt) |
51% 25% (10% abgesetzt) |
| Toxizitätsindex | 0,82 | 0,74 |
| LQ Index | 1,16 | 0,73 |
Einen typischen Therapievergleich zwischen einer mit Temodal® behandelten Patientengruppe und einer Vergleichsgruppe, die mit einem Carbazin (MTIC) behandelt worden war, gibt Tabelle II. Es handelt sich um eine randomisierte Studie bei GBM-Patienten nach dem ersten Rezidiv.7 Sowohl Fallzahl, Alter und Allgemeinzustand (sog. KPS-Score) als auch die Vorbehandlung der beiden Patientengruppen waren vergleichbar. In beiden Gruppen waren fast alle Patienten im Beobachtungszeitraum von 18 Monaten bereits verstorben. Die IntÜZ betrug in der Temodal®-Gruppe 8,03 Monate und in der Carbazin-Gruppe 7,16 Monate. Der TI betrug unter Temodal® 0,82 und unter Carbazin 0,74, und der LQI betrug 1,16 gegenüber 0,73. Aus diesen Daten können die Qualy für Temodal® und Carbazin berechnet werden:
Temodal®: Qualy = 8,03 x 0,82 x 1,16 = 7,64
Carbazin: Qualy = 7,16 x 0,74 x 0,73 = 3,87
Aus diesen Kennziffern errechnen sich für die Behandlung mit Temodal® im Vergleich zu Carbazin folgende Vorteile: Der Qualy-Gewinn beträgt 3,77 Monate, die Effektivität beträgt 46,9% und der Gewinnfaktor beläuft sich auf 1,97. Das heißt, Temodal® wirkt bei rezidiviertem GBM dieser Studie zufolge um knapp das zweifache besser als Carbazin.
Ein weiterer Therapievergleich konnte für Patienten mit neu diagnostiziertem GBM gezogen werden.8 Obzwar es sich um Patienten aus zwei verschiedenen Studien handelt (randomisierte prospektive Studien mit Temodal® an neu diagnostizierten GBM-Fällen wurden bisher noch nicht publiziert) sind die Kenngrößen der Patienten in beiden Gruppen insgesamt ähnlich, sodass ein Vergleich der beiden Studienergebnisse zulässig erscheint (Evidenzgrad IIb). Im einen Fall wurde Temodal®, im anderen Fall die ältere Kombination eines Carbazins (DTIC) mit Fotemustin angewandt (DF-Schema) (siehe Tabelle III). Der Beobachtungszeitraum betrug 36 Monate. Nach dieser Zeit waren in der Temodal®-Gruppe noch 25%, in der Vergleichsgruppe noch 20% der Patienten am Leben. Die IntÜZ betrug unter Temodal® 17,93 Monate, unter DF 19,62 Monate. Die MedÜZ war hingegen unter der Therapie mit Temodal® länger (16 vs. 14,5 Monate). Das deutet auf eine höhere Ansprechrate aber eine kürzere Wirksamkeit der alternativen Therapieform. Der TI bzw. LQI betrugen in der Temodal®-Gruppe 0,78 respektive 1,10, in der DF-Gruppe 0,67 respektive 0,90. Aus diesen Daten können auch hier die Qualy für Temodal® und die alternative Therapieform berechnet werden:
Temodal®:
Qualy = 17,93 x 0,78 x 1,10 = 15,38
DF-Schema:
Qualy = 19,62 x 0,67 x 0,90 = 11,83
| Stupp et al. (2002) | Fazeny-Dörner et al. (2003) | |
| Fallzahl | 58 (ITT 64) | 55 |
| Alter | 52 (1/3 < 50) | 44 (2/3 < 50) |
| KPS-Score | 90 (80 - 100) | 90 (60 - 100) |
| Vorbehandlung |
Chir (42k,34ik,23b) XRT 60 Gy/6 Wochen |
Chir (43k,36ik,21b) XRT 60 Gy/6 Wochen |
|
Intervall Dg.-XRT/Chth. |
25 (14 - 45) Tage | 20 - 30 Tage |
| Chemotherapie (Start zugleich mit XRT) |
TMZ 75mg/m2 x 42d 4 Wochen Pause TMZ 200mg/m2 x 5d alle 28d (max. 6x) |
DTIC 200mg/m2 i.v. FOT 100mg/m2 i.v. Wiederholung nach 3 Wochen (max. 8x) |
|
MedÜZ (Monate) %Überleben 12 M 18 M 24 M IntÜZ (bis 36 Mo) |
16 (11 - 21) 58% 36% 31% 17,93% |
14,5 (7 - 28) 58% 49% 44% 19,62% |
| Toxizität |
4x abgesetzt (2x Infektion, 2x Thp) 80% Lyp Grad 3/4 14% Thp Grad 3/4 |
5x abgesetzt (4x Thp, 1x Erythrod.) 1x Septicämie |
| Nebenwirkungen |
30% Antiemetica 16% Fatigue |
100% Antiemetica 33% Alopecie |
| Toxizitätsindex | 0,78 | 0,67 |
| LQ Index | 1,10 | 0,90 |
Aus diesen Kennziffern errechnen sich für die Behandlung mit Temodal® im Vergleich zum alternativen Therapieschema folgende Vorteile: Der Qualy-Gewinn beträgt 3,55 Monate, die Effektivität beträgt 19,8% und der Gewinnfaktor beläuft sich auf 1,30. Das heißt, Temodal® wirkt um das 1,3-fache besser als diese alternative Therapieform.
Auf diese Weise also konnte die Relevanz der Therapie mit Temodal® im Vergleich zu älteren Therapieformen für rezidivierte und neu diagnostizierte GBM Patienten quantifiziert werden. Es zeigte sich, dass Patienten, welche mit Temodal® behandelt wurden, im Vergleich zu älteren Therapieformen hinsichtlich ihrer Lebenserwartung zwar kaum profitieren, jedoch eine bessere Lebensqualität aufweisen und mit weniger toxischen Nebenwirkungen belastet sind. Ungeklärt bleibt allerdings die Frage, ob eine adjuvante Chemotherapie mit Temodal® oder den klassischen Substanzen aus heutiger Sicht überhaupt sinnvoll ist. Für Temodal® gibt es für GBM keine Vergleichsstudien zu einer Behandlung nach den Richtlinien von „best supportive care". Solche Studien existieren nur für die älteren Substanzen (vgl. Tabelle I). Diese 20 – 30 Jahre zurückliegenden Studien haben einen 10%igen Effekt der adjuvanten Chemotherapie nachgewiesen, der unter Berücksichtigung jüngerer Studien (Abbildung I) nur mehr 6% betrug. Ob sich in Anbetracht der heutigen Möglichkeiten einer besten Palliativtherapie dieser Effekt überhaupt noch zeigen würde, darf zu Recht bezweifelt werden. Indirekte Hinweise können aus Studien abgeleitet werden, welche Temodal® zur Behandlung von metastatischen Gehirntumoren einsetzen.9 Eine rezente derartige Phase II-Studie weist für Temodal® plus Radiotherapie eine MedÜZ von 8,6 Monaten aus, gegenüber 7,0 Monaten für Radiotherapie allein. Dieser Unterschied war nicht signifikant (p = 0,45). Übelkeit, Erbrechen und Thrombozytopenien hingegen waren in der Temodal®-Gruppe signifikant häufiger.
III Übergang von der Relevanz zur Effizienz
Die Sinnorientierte Medizin spricht von der Verhältnismäßigkeit als jenem „Kriterium, das die Gesamtheit der für eine Therapieentscheidung relevanten Faktoren einbezieht und die Brücke schlägt zwischen der allgemein normativen und der konkret dem Einzelfall angemessenen Ebene".10 Es gibt eine menschlich-private und eine gesellschaftlich-öffentliche Dimension der Verhältnismäßigkeit. Während in der privaten Sphäre persönliche Umstände und Voraussetzungen (Alter, Bewusstseinslage, Zukunftspläne etc.) eine Rolle spielen, werden in der öffentlichen Sphäre ökonomische Faktoren (welche durch die Institution der Krankenversicherung aus der privaten Sphäre weitgehend ausgelagert sind) dominant. Dabei kommen nicht nur Fragen der Gerechtigkeit, sondern auch solche der Klugheit zum Zuge. Denn der Lebenswert eines Menschen ist gegen ökonomische Werte prinzipiell nicht abwägbar, weil beide Wertbereiche inkommensurabel sind. Allein die Klugheit vermag inkommensurable Größen zueinander ins Maß zu setzen.
Richtlinie für die Klugheitsentscheidung ist die Analogie. Dabei gilt es, die Kosten und die Wirksamkeit der einen Behandlung mit den Kosten und der Wirksamkeit einer anderen Behandlung zu vergleichen. Zunächst können durch Angabe des Kostenfaktors die Aufwendungen für die eine Behandlung in Relation zu den Aufwendungen für eine andere Behandlung gestellt werden. Der Kostenfaktor ist daher ihrem Quotienten gleich. Er gibt an, um wie viel die eine (neue) Therapie teurer ist als die andere (alte).
Wenn man neben den Kosten auch die Wirksamkeit verschiedener Behandlungen vergleicht, so ergibt sich daraus ein Maß für die Kostenverhältnismäßigkeit oder die Kosteneffizienz. Die Kosteneffizienz kann einerseits intern, andererseits extern bestimmt werden. Die interne Kosteneffektivität vergleicht die Kosten im Verhältnis zum Gewinn. Die Verhältnismäßigkeit ist dann gegeben, wenn Kostenfaktor und Gewinnfaktor gleich hoch sind. Daher gilt:
Sollkosten = Monatskosten Kontrolle x Gewinnfaktor
Istkosten = Monatskosten Therapie
Das Verhältnis von Istkosten zu Sollkosten ergibt den Internen Überzahlungsfaktor. Er gibt an, in welchem Verhältnis die Kosten der neuen Therapie zu den Kosten der alten stehen.
Die externe Kosteneffektivität vergleicht die Kosten der zu prüfenden Therapie mit einer zu 100% effektiven Standardtherapie. Als anerkannter Standard gilt die Dialysetherapie, deren Kosten mit EUR 3.000,– pro gewonnenem Monat angenommen sind. Auch hier wird wieder eine Ist- und eine Sollkostengröße errechnet. Die Sollkosten sind gleich den Kosten für einen gewonnenen Monat des gewählten Standards. Die Istkosten sind gleich den tatsächlichen Kosten für einen gewonnenen Monat durch die neue Therapie. Daraus ergibt sich als Quotient (Istkosten bezogen auf Sollkosten) der Externe Überzahlungsfaktor. Er gibt an, in welchem Verhältnis die Kosten der neuen Therapie zu den Kosten eines etablierten Standards stehen.
Um einen Therapievergleich hinsichtlich ihrer Kosteneffizienz ziehen zu können, ist es notwendig, die Therapiekosten pro Therapiezyklus für jede der Therapieformen auf Grund von Erfahrungswerten abzuschätzen. Zu den Therapiekosten bei GBM zählen einerseits palliative (nicht tumorspezifische) Maßnahmen inklusive Maßnahmen der Krisenintervention. Sie umfassen pflegerische Maßnahmen, gelegentliche Laborkontrollen, gelegentliche bildgebende Untersuchungen und symptomatische Behandlungen (z. B. Cortison, Anticonvulsiva, Schmerzmittel). Kosten für solche Maßnahmen gelten als basal und werden nicht eigens berücksichtigt. Andererseits ergeben sich Kosten für die zusätzliche zytostatische Therapie. Dazu zählen: Arzneimittel, deren Zubereitung und Verabreichung, regelmäßige (z. B. monatliche) ausführliche Laborkontrollen, Behandlung toxischer Nebenwirkungen (Antiemetica, Hämoderivate, Antibiotica) und regelmäßige bildgebende Überwachung. Diese Kosten werden für den Vergleich berücksichtigt und getrennt für das Arzneimittel und die übrigen Maßnahmen (unter „Nebenkosten") gelistet.
Im Folgenden werden die Kosten pro 4 Wochen für die einzelnen oben angeführten Therapieformen behandelt und daraus aufgrund der gegebenen Richtlinien ihre Kosteneffizienz errechnet (siehe Berechnung I).
Wie sich zeigt, ist nicht nur im internen, sondern auch im externen Vergleich die Therapie mit Temodal® zu teuer, und zwar intern um das 3,4-fache und extern um das 1,2-fache. Die Kostenverhältnismäßigkeit ist daher nicht gegeben. Ob auch eine Behandlung mit Carbazin unverhältnismäßig wäre, ließe sich nur im Vergleich mit einer Palliativbehandlung berechnen.
Neu diagnostizierte Fälle haben nach chirurgischer Intervention plus Radiotherapie eine längere Lebenserwartung und sprechen auf adjuvante Therapie generell besser an als Rezidivfälle. Aber auch hier zeigt sich sowohl im internen als auch im externen Vergleich, dass die Therapie mit Temodal® um das rund zweifache zu teuer ist (siehe Berechnung II).
De facto sind beide Therapien gleich gut, aber die D-F-Kombination ist um den Faktor 2,65 billiger. Der Nettounterschied beträgt € 1.080,– pro Monat. Die Kostenverhältnismäßigkeit ist daher nicht gegeben.
Zusammenfassung und Schlussfolgerungen
Bösartige primäre Hirntumore vom Typ des GBM stellen eine außerordentliche Herausforderung für Patienten, medizinische Helfer und Angehörige dar. Die medizinischen Möglichkeiten sind begrenzt, die Prognose letztlich infaust. Es ist daher verständlich, dass jeder Hoffnungsschimmer, den eine neue Behandlungsmöglichkeit zu bieten verspricht, von Helfern und Hilfsbedürftigen gleichermaßen aufgegriffen wird.
Das seit 5 Jahren auf dem Markt befindliche und von der Arzneimittelkommission zur Behandlung bösartiger Hirntumore zugelassene Zytostatikum Temodal® (Schering) stellt zweifellos eine Neuerung im Spektrum der etablierten Chemotherapien dar. Es erreicht einen höheren Spiegel am Ort seiner Wirkung, ist leicht administrierbar, gut verträglich und mit weniger Nebenwirkungen behaftet als vergleichbare Mittel. Zu Recht wurde es daher innerhalb der letzten 10 Jahre intensiv beforscht und auch beworben. Es ist auch nicht verwunderlich, dass ein solches Medikament, für dessen Entwicklung und klinische Erprobung eine Arzneimittelfirma außerordentlich hohe Summen aufbringen muss, auch seinen Preis hat. Für den Endverbraucher kommt es jedoch einzig und allein darauf an, was das neue Mittel im Vergleich zu anderen konservativen Möglichkeiten und in Relation zu deren Kosten zu leisten vermag.
In einem Stadium, in welchem die Forschungen zu Temodal® noch im Fluss und Studien von unbezweifelbarer Evidenz noch ausständig sind, kann aufgrund der durchgeführten Berechnungen über den Einsatz von TMZ bei hochgradig malignen Gliomen nach den Richtlinien einer sinnorientierten Medizin die folgende Stellungnahme abgegeben werden:
Richtet man sich nach den Qualitätskriterien von Good Clinical Practice (GCP) for Trials on Medicinal Products in der Europäischen Gemeinschaft, so konnte bisher weder hinsichtlich einer Lebensverlängerung noch in Bezug auf die Lebensqualität ein statistisch gesicherter Beweis erbracht werden, dass Temodal® verglichen zur herkömmlichen Chemotherapie einen Vorteil aufweist. Lässt man fehlende statistische Signifikanzen außer Acht, so ist in Bezug auf die Toxizität bzw. Lebensqualität bei Temodal im Vergleich mit herkömmlichen Chemotherapeutika ein gewisser Vorteil erkennbar. Dieser Vorteil kann mit Hilfe der Berechnung von so genannten Quality Adjusted Life Years (Qualy) allerdings nur auf wenige Wochen beziffert werden. Er ist in erster Linie durch einen geringeren Verbrauch von Antiemetika und vielleicht seltenere Krankenhausaufnahmen fassbar.
Eine Kosten-/Nutzen-Analyse zeigt, dass die Kosten einer Temodal®-Therapie ein Vielfaches der herkömmlichen Behandlung ausmachen und in keinem Verhältnis zu den geringen Vorteilen stehen.
Daraus lassen sich folgende Schlussfolgerungen ziehen:
- Die herkömmliche Standardtherapie, sowohl adjuvant aber auch im fortgeschrittenen Stadium eines Glioblastoms, ist praktisch gleich wirksam wie eine Temodal®-Therapie.
- Die geringere Toxizität von Temodal® rechtfertigt die bis zu 3fach höheren Kosten kaum. Dabei übersteigen die Kosten auch objektiv deutlich diejenigen z. B. für eine Dialysebehandlung, ohne dass damit auch nur annähernd deren Effektivität erreicht wird.
- Es kann davon ausgegangen werden, dass die etwas größere Toxizität der herkömmlichen Therapie mit den heutigen Möglichkeiten einer qualifizierten palliativen und supportiven Begleitbehandlung weitgehend ausgeglichen werden kann.
- Diese Aussagen gelten gleichermaßen für die first-line-Behandlung an neu diagnostizierten Fällen als auch für eine Salvage-Therapie nach Rezidiv.
- Ganz allgemein soll noch darauf hingewiesen werden, dass jede Chemotherapie bei Glioblastomen nur einen sehr geringen Effektivitätsgrad hat, sodass die Sinnhaftigkeit einer solchen Behandlung zu hinterfragen und Alternativkonzepte (z. B. eine modifizierte Radiotherapie (siehe Einleitung)) in Kombination mit einer qualifizierten Palliativtherapie zu überlegen wären.11
- Der Vollständigkeit halber sei noch erwähnt, dass sämtliche angeführten Therapieformen ambulant oder stationär durchgeführt werden können. Auch in Bezug auf eine ambulante Behandlung kann bei Temodal® kein relevanter Vorteil im Hinblick auf die Lebensqualität festgestellt werden.
- Die Therapiestrategie sollte bei jedem Patienten individuell erfolgen. Eine mögliche Vorgangsweise wäre, die Temodal®-Therapie nicht als first-line-Therapie bei jedem Patienten zu verabreichen, wohl aber als second-line-Therapie bei Unverträglichkeit der herkömmlichen Chemotherapie. Dadurch könnten erheblich Kosten eingespart werden, ohne dass der Patient dadurch substantielle Nachteile in Kauf nehmen müsste.
Referenzen
- Chang C. N. et al., High-dose-rate stereotactic brachytherapy for patients with newly diagnosed glioblastoma multiforme, J Neuro-Oncol (2003); 61: 45-55
- Fine H. A. et al., Meta-analysis of radiation therapy with and without adjuvant chemotherapy for malignant gliomas in adults, Cancer (1993); 71: 2585-2597
- Glioma Meta-Analysis Trialists Group (Stewart l. a. et al.), Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomized trials, Lancet (2002); 359: 1011-1018
- Newlands E. S. et al., Temozolomide: a review of its discovery, chemical properties, pre-clinical development and clinical trials, Cancer Treat Rev (1997); 23: 35-61
- Bonelli J. et al., Medical care concepts beyond evidence based medicine: Decision making modeling of lifetime gain with cost benefit analysis for individual patients, Int J Clin Pharmacol Ther (in Druck)
- Detsky A. S., Naglie I. G., A Clinician’s Guide to Cost-effectiveness Analysis, Ann Int Med (1990); 113: 147-154
- Yung W. K. A. et al., A phase II study of temozolomide vs. Procarbazine in patients with glioblastoma multiforme at first relapse, Br J Cancer (2000); 83: 588-593
Osoba D. et al., Health-related quality of life in patients treated with temozolomide vs. Procarbazine for recurrent glioblastoma multiforme, J Clin Oncol (2000); 18: 1481-1491 - Stupp R. et al., Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide, J Clin Oncol (2002); 20: 1375-1382
Fazeny-Dörner B. et al., Survival with dacarbazine and fotemustinne in newly diagnosed glioblastoma multiforme, Br J Cancer (2002); 88: 496-501 - Antonadou D. et al., Phase II randomized trial of temozolomide and concurrent radiotherapy in patients with brain metastases, J Clin Oncol (2002); 20: 3644-3650
- Bonelli J., Prat E. H., Sinnorientierte Medizin (S.O.M.). Paradigmenwechsel in der Medizin: von der Machbarkeit zur Sinnhaftigkeit – Medizin für den Einzelfall, Imago Hominis (1999) 6: 187-207
- vgl. Bonelli J., Sinnorientierte Medizin, Imago Hominis (2004); 11: 251-264
Dr. Walter Rella
Küb Nr. 12, A-2671 Küb
walterrella(at)gmx.at